题目内容
将金属Fe、Cu与FeCl3、FeCl2溶液放入同一烧杯中,根据下列情况说明:在溶液里哪些离子和金属单质能同时存在?哪些不能同时存在?
(1)所剩余的固态滤出后能被磁铁吸引,则反应后存在较多的阳离子可能是 ,烧杯中还存在金属 .
(2)反应后除Cu2+外,还有相当量的Cu,则烧杯里不可能有 .
(3)若除Cu2+外还有相当量的Fe3+,则可能还有 .
(1)所剩余的固态滤出后能被磁铁吸引,则反应后存在较多的阳离子可能是
(2)反应后除Cu2+外,还有相当量的Cu,则烧杯里不可能有
(3)若除Cu2+外还有相当量的Fe3+,则可能还有
考点:铜金属及其重要化合物的主要性质,铁的化学性质
专题:元素及其化合物
分析:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,将金属Fe、Cu与FeCl3、FeCl2溶液放入同一烧杯中,则铁和铜都能与氯化铁溶液反应.氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,Fe有剩余,则Cu没有参加反应,溶液中不存在Fe3+、Cu2+,以此解答该题.
解答:
解:(1)所剩余的固态滤出后能被磁铁吸引,则Fe剩余,发生Fe+2FeCl3=3FeCl2,Fe+CuCl2=Cu+FeCl2,Fe3+、Cu2+都不能存在,存在较多的阳离子可能是Fe2+,烧杯中金属为Fe、Cu,
故答案为:Fe2+;Fe、Cu;
(2)反应后除Cu2+外,还有相当量的Cu,由Fe+CuCl2=Cu+FeCl2、Cu+2FeCl3=2CuCl2+CuCl2可知,则Fe不可能存在,不存在Fe3+,故答案为:Fe3+、Fe;
(3)若除Cu2+外还有相当量的Fe3+,由(1)和(2)的分析可知,Fe、Cu均完全反应,溶液中含Fe3+、Cu2+、Fe2+,故答案为:Fe2+.
故答案为:Fe2+;Fe、Cu;
(2)反应后除Cu2+外,还有相当量的Cu,由Fe+CuCl2=Cu+FeCl2、Cu+2FeCl3=2CuCl2+CuCl2可知,则Fe不可能存在,不存在Fe3+,故答案为:Fe3+、Fe;
(3)若除Cu2+外还有相当量的Fe3+,由(1)和(2)的分析可知,Fe、Cu均完全反应,溶液中含Fe3+、Cu2+、Fe2+,故答案为:Fe2+.
点评:本题考查氧化还原反应以及铁、Cu的单质化合物的性质,为高频考点,本题关键是把握物质的氧化性、还原性强弱判断反应的先后顺序,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是( )
| A、Mg、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |
 选用滴定管
选用滴定管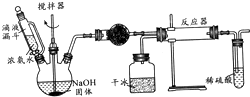 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为