题目内容
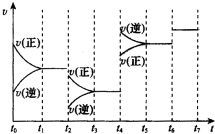
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+B(g)?2C(g)△H<0,第5min时达到化学平衡后,只改变反应的一个条件,按要求在图中画出正逆反应速率变化图:第6min时,加入C物质,第8min时达到平衡;第9min时改变的条件是降低温度,第12min时达到平衡;第13min时改变的条件是增大压强,第15min时达到平衡.
分析 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+B(g)?2C(g)△H<0,反应是气体体积不变的放热反应,第5min时达到化学平衡,正反应速率减小,逆反应速率增大,到5min正逆反应速率相同,反应达到平衡状态,5min-6min出现平台,此时加入C物质,瞬间逆反应速率突然增大,AB此时浓度不变,反应速率不变,随反应进行,逆反应速逐渐地减小,AB浓度增大,即逆反应速率减小,正反应速率增大,第8min时达到平衡正逆反应速率相同,条件不变,8min-9min出现平台,第9min时改变的条件是降低温度,正逆反应速率都减小,速率曲线低于平衡点,正反应是放热反应,降低温度,平衡正向进行,逆反应速率减小的多,正反应速率减小的少,随反应减小正反应速率减小,逆反应速率增大,最后第12min时达到平衡,正逆反应速率相同达到平衡状态,第13min时改变的条件是增大压强,反应是前后气体体积不变的反应,增大压强,正逆反应速率同等程度增大,但平衡不变,据此画出变化的图象.
解答 解:某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+B(g)?2C(g)△H<0,反应是气体体积不变的放热反应,反应达到平衡状态的阶段有:
正反应速率减小,逆反应速率增大,到5min正逆反应速率相同,反应达到平衡状态,
5min-6min出现平台,平衡不变,
6min-8min,第6min时此时加入C物质,瞬间逆反应速率突然增大,AB此时浓度不变,反应速率不变,随反应进行,逆反应速逐渐地减小,AB浓度增大,即逆反应速率减小,正反应速率增大,第8min时达到平衡正逆反应速率相同,
条件不变,8min-9min出现平台,
9min-12min,第9min时改变的条件是降低温度,正逆反应速率都减小,速率曲线低于平衡点,正反应是放热反应,降低温度,平衡正向进行,逆反应速率减小的多,正反应速率减小的少,随反应减小正反应速率减小,逆反应速率增大,最后第12min时达到平衡,正逆反应速率相同达到平衡状态,
12min-13min出现平台,
13min-15min,第13min时改变的条件是增大压强,反应是前后气体体积不变的反应,增大压强,正逆反应速率同等程度增大,但平衡不变,13min到第15min出现平台,据此画出变化的图象为: ,
,
故答案为: ;
;
点评 本题考查化学平衡图象绘制,注意图象中反应速率的变化及平衡移动,明确温度、浓度、压强对反应速率及平衡的影响即可解答,题目难度中等.

 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
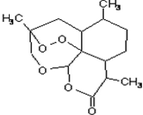 青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )
青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )| A. | 分子式是C15H22O5 | |
| B. | 易溶于水,乙醇和乙醚 | |
| C. | 含有-O-O-键,具有较强的氧化性 | |
| D. | 1mol青蒿素可以和1molH2发生加成反应 |
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
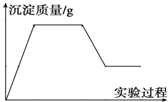 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
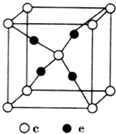 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.