题目内容
3.下列说法错误的是( )| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
分析 A.Na2CO3和NaHCO3均与Ba(OH)2或Ca(OH)2溶液反应生成白色沉淀;
B.NaHCO3加热分解生成碳酸钠;
C.HCl、SO2等气体均与饱和NaHCO3溶液反应生成二氧化碳;
D.澄清石灰水少量完全反应,生成碳酸钙、水、碳酸钠.
解答 解:A.Na2CO3和NaHCO3均与Ba(OH)2或Ca(OH)2溶液反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.NaHCO3加热分解生成碳酸钠,则加热可分离提纯,故B正确;
C.HCl、SO2等气体均与饱和NaHCO3溶液反应生成二氧化碳,则用饱和NaHCO3溶液、洗气提纯气体,故C正确;
D.澄清石灰水少量完全反应,生成碳酸钙、水、碳酸钠,则开始时发生反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故D正确;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.下列各项叙述中错误的是( )
| A. | 使用SO2漂白过的物品在使用过程中会慢慢恢复为漂白前的颜色 | |
| B. | 向含有纯碱的废水中加入适量生石灰,可以消除水中的污染 | |
| C. | 大量焚烧田间秸秆会促进雾霾的形成 | |
| D. | 用热碱水吸收有利于除去手上的油脂形成的污渍 |
11.下列溶液中的离子一定能大量共存的是( )
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
15.甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是极性分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的$\frac{3}{5}$.
①达到平衡时,CO的转化率为60%
②下列选项能判断该反应达到平衡状态的依据的有ce
a.2v(H2)=v(CH3OH)
b.CO的消耗速率等于CH3OH的生成速率
c.容器内的压强保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-bkl•mol-1
③H2O(g)═H2O(1)△H=-ckJ•mol-1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=$\frac{b-a-4c}{2}$kJ•mol-1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨做电极电解200mL含有如表离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为3.2g.
(1)甲醇分子是极性分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的$\frac{3}{5}$.
①达到平衡时,CO的转化率为60%
②下列选项能判断该反应达到平衡状态的依据的有ce
a.2v(H2)=v(CH3OH)
b.CO的消耗速率等于CH3OH的生成速率
c.容器内的压强保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-bkl•mol-1
③H2O(g)═H2O(1)△H=-ckJ•mol-1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=$\frac{b-a-4c}{2}$kJ•mol-1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨做电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| 浓度(c/mol•L-1) | 0.5 | 2 | 2 | 0.5 |
13.将过量的铁粉投入到盛有硫酸铜和稀硫酸的混合溶液中,充分反应后,过滤,滤液中含有物质是( )
| A. | 硫酸铁 | B. | 硫酸铜 | C. | 硫酸 | D. | 硫酸亚铁 |
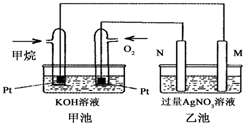 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
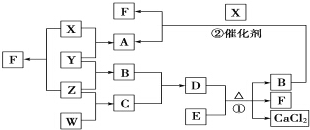 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.