��Ŀ����
����Ԫ��W��X��Y��Z��ԭ��������������W��ԭ�������������Ǵ�����������3����X��Y��Z������ͬ�����ڣ����ǵ�ԭ������֮����Wԭ��������5��������Ԫ��W��X��Y��Z��ɵ����п��ܵĶ���ֻ������У���Ԫ��W��Y�γɵĻ�����M���۵���ߣ���ش��������⣺
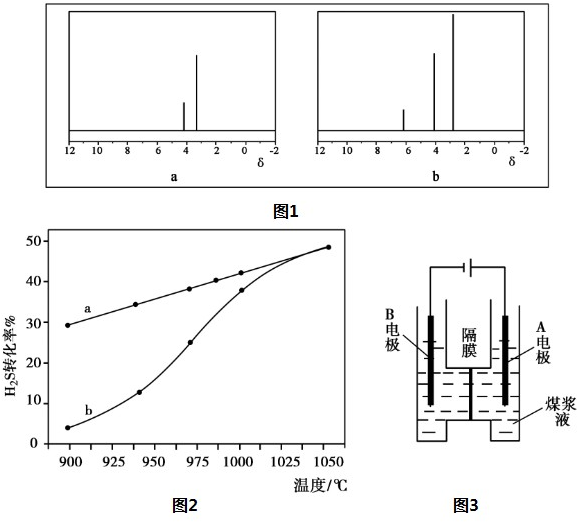
��1��W3���ӿռ乹��Ϊ ��
��2������WX2��������ԭ��W�ŵ��Ӷ��� ��������ԭ�ӵ�VSEPRģ������Ϊ ���÷������� ���ӣ�����ԡ��Ǽ��ԡ���
��3��д��M�ĵ���ʽ ��M�������������������ӵİ뾶��Ϊ0.514�����Ʋ�M����ľ��������� ������ͼ��ѡ��
��1��W3���ӿռ乹��Ϊ
��2������WX2��������ԭ��W�ŵ��Ӷ���
��3��д��M�ĵ���ʽ

���㣺λ�ýṹ���ʵ����ϵӦ��,�жϼ��ӻ����ӵĹ���,�����ļ���
ר�⣺Ԫ����������Ԫ�����ڱ�ר��,��ѧ���뾧��ṹ
����������Ԫ��W��X��Y��Z��ԭ��������������W��ԭ�������������Ǵ�����������3����Wԭ��ֻ����2�����Ӳ㣬����������Ϊ6����WΪOԪ�أ�X��Y��Z������ͬ�����ڣ����ǵ�ԭ������֮����Wԭ��������5��������Ԫ��ԭ������֮��Ϊ40��X��Ϊ��������Ԫ�أ�X��Y��Z��ԭ������֮�ʹ���Wԭ��������5�������Կ��Զ϶�XҲ�ڵڶ����ڣ���XΪFԪ�أ���Y��Zԭ������֮��=40-9=31��ƽ��ԭ������Ϊ15.5�������ƶ�Y���ڵ������ڡ�Z���ڵ������ڣ�Z��ԭ����������18����YΪNaԪ�أ���ZΪCaԪ�أ���YΪMgԪ�أ���ZΪKԪ�أ�X��ԭ�������������������⣬����Ԫ��W��Y�γɵĻ�����M���۵���ߣ���YΪMgԪ�أ�ZΪKԪ�أ�������MΪMgO���ݴ˽��
���
�⣺����Ԫ��W��X��Y��Z��ԭ��������������W��ԭ�������������Ǵ�����������3����Wԭ��ֻ����2�����Ӳ㣬����������Ϊ6����WΪOԪ�أ�X��Y��Z������ͬ�����ڣ����ǵ�ԭ������֮����Wԭ��������5��������Ԫ��ԭ������֮��Ϊ40��X��Ϊ��������Ԫ�أ�X��Y��Z��ԭ������֮�ʹ���Wԭ��������5�������Կ��Զ϶�XҲ�ڵڶ����ڣ���XΪFԪ�أ���Y��Zԭ������֮��=40-9=31��ƽ��ԭ������Ϊ15.5�������ƶ�Y���ڵ������ڡ�Z���ڵ������ڣ�Z��ԭ����������18����YΪNaԪ�أ���ZΪCaԪ�أ���YΪMgԪ�أ���ZΪKԪ�أ�X��ԭ������������������Ŀ������Ԫ�ص�Ҫ������Ԫ��W��Y�γɵĻ�����M���۵���ߣ���YΪMgԪ�أ�ZΪKԪ�أ�������MΪMgO��
��1��O3������������ԭ�Ӽ۲���Ӷ���=2+
=3������1�Թµ��Ӷԣ���O3�ռ乹��ΪV�ͣ�
�ʴ�Ϊ��V�ͣ�
��2��OF2��������ԭ��O�ŵ��Ӷ���=
=2���۲���Ӷ���=2��������ԭ�ӵ�VSEPRģ��Ϊ�������壬�÷���ΪV�ͽṹ������������������IJ��غϣ����ڼ��Է��ӣ�
�ʴ�Ϊ��2���������壻���ԣ�
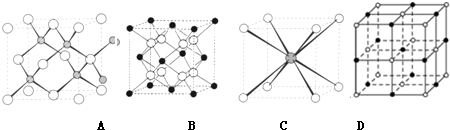
��3��������MΪMgO���������ӻ���������ʽΪ�� ��M�������������������ӵİ뾶��Ϊ0.514�����ݰ뾶�ȹ�����0.414��0.732֮�䣬������λ��Ϊ6����ͼ��D���ϣ�
��M�������������������ӵİ뾶��Ϊ0.514�����ݰ뾶�ȹ�����0.414��0.732֮�䣬������λ��Ϊ6����ͼ��D���ϣ�
�ʴ�Ϊ�� ��D��
��D��
��1��O3������������ԭ�Ӽ۲���Ӷ���=2+
| 6-2��2 |
| 2 |
�ʴ�Ϊ��V�ͣ�
��2��OF2��������ԭ��O�ŵ��Ӷ���=
| 6-1��2 |
| 2 |
�ʴ�Ϊ��2���������壻���ԣ�
��3��������MΪMgO���������ӻ���������ʽΪ��
 ��M�������������������ӵİ뾶��Ϊ0.514�����ݰ뾶�ȹ�����0.414��0.732֮�䣬������λ��Ϊ6����ͼ��D���ϣ�
��M�������������������ӵİ뾶��Ϊ0.514�����ݰ뾶�ȹ�����0.414��0.732֮�䣬������λ��Ϊ6����ͼ��D���ϣ��ʴ�Ϊ��
 ��D��
��D��
�������������ʽṹ�����ʣ��漰Ԫ���ƶϡ����ӽṹ�����ʡ�����ṹ�ȣ��Ѷ��еȣ��ƶ�Ԫ���ǽ���Ĺؼ���Ҫ�������ԭ�������Ĺ�ϵ������ڱ��Ľṹ�����ж�Ԫ�أ���3���о����ṹ�ж�Ϊ�״��㡢�ѵ㣬��ѧ�������漰�뾶�ȹ��ɣ�

��ϰ��ϵ�д�
 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
�����Ŀ
ClO2����һ������ˮ�����������������ҵ�����ˮ������ClO2����Cl2����������ˮ�������ҹ�����ɹ����Ƴ���ȡClO2���·������䷴Ӧ���۹�����ͼ��ʾ��
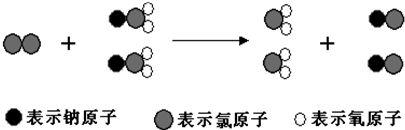
�����й���������ȷ���ǣ�������

�����й���������ȷ���ǣ�������
| A���÷�Ӧ�Ǹ��ֽⷴӦ |
| B��ClO2 ������Ч�ʣ�������ʱ�õ����ӵĶ��٣���Cl2 ��2.63�� |
| C����Ӧ��Cl2���������������ǻ�ԭ�� |
| D������2mol ClO2ʱת�Ƶĵ�����Ϊ6mol |
 ��������������ˮ��ɱ��������
��������������ˮ��ɱ��������
 ���ԭ���ڻ�ѧ��ҵ���й㷺��Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
���ԭ���ڻ�ѧ��ҵ���й㷺��Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
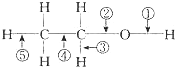 ���Ҵ��Ļ�ѧ�����У�����Ӧ�Ķϼ���ʽ�ɸ������£�
���Ҵ��Ļ�ѧ�����У�����Ӧ�Ķϼ���ʽ�ɸ������£�