��Ŀ����
4�������й�ʵ���������ʵ�Ľ�����ȷ���ǣ�������| ѡ�� | ʵ���������ʵ | ���� |
| A | ���������Һ��SO42-���ȵ���ϡ���ᣬ�ٵ���BaCl2��Һ | �ȵ���������ų�Ag+��CO3-��SO32-�����Ӹ��� |
| B | ��������ϡ������ | �������汻HNO3�����γ����ܵ�����Ĥ |
| C | ��Fe��NO3��2��Һ�м���ϡ���ᣬ�Թܿ��к���ɫ������� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
| D | ��Mg��HCO3��2��Ӳˮ��ʱ���ּ��ȣ����յõ��ij��������Ҫ�ɷ�ΪMg��OH��2������MgCO3 | Kap��MgCO3����Kap[Mg��OH��2] |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A���������ų��������ӣ�
B�����ܹ�����ϡ���
C����Fe��NO3��2��Һ�м���ϡ���ᣬ�����������������������ǿ�����ԣ�
D�����յõ��ij��������Ҫ�ɷ�ΪMg��OH��2��������MgCO3��������þ�����ܣ�
��� �⣺A���������ų��������ӣ��ٵ���BaCl2��Һ�����ɰ�ɫ�����ɼ�����������ӣ���A��ȷ��
B������Ũ���ᷢ���ۻ���Ӧ��������ϡHNO3����B����
C����Fe��NO3��2��Һ�м���ϡ���ᣬ�����������������������ǿ�����ԣ�����Һ��NO3-��Fe2+��ԭΪNO��Ȼ��NO����������NO2����C����
D�����յõ��ij��������Ҫ�ɷ�ΪMg��OH��2��������MgCO3��������þ�����ܣ���Kw��MgCO3����Kw[Mg��OH��2]����D����
��ѡA��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�漰���ӵļ��顢������ԭ��Ӧ�������Ʊ�ʵ��ȣ�����ʵ��ԭ����ʵ�����Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
6�������йػ�ѧ�����ʾ����ȷ���ǣ�������
| A�� | F-�Ľṹʾ��ͼ��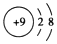 | |
| B�� | ������Ϊ20����ԭ�ӣ�${\;}_{17}^{20}$Cl | |
| C�� | S2-�Ľṹʾ��ͼ��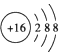 | |
| D�� | ԭ�Ӻ�����18�����ӵ���ԭ�ӣ�${\;}_{17}^{35}$Cl |
7����ѧ������������أ������й�˵��������ǣ�������
| A�� | SO2��NO2����Ҫ�Ĵ�����Ⱦ�� | |
| B�� | �����е�SO2��CO2����ˮ�γ����� | |
| C�� | ��Һ��ʯ��������ȼ�Ϳɼ��ٴ�����Ⱦ | |
| D�� | ��úȼ�պ��γɵ���������Ŀǰ��Ҫ��ʯ�ҷ� |
11��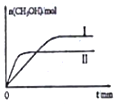 ��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
��1����֪��H2O��g��=H2O��l����H=44KJ/mol
����д��ú��������Ӧ���ɺϳ�����CO��H2�����Ȼ�ѧ����ʽH2O��g��+C��s��=CO��g��+H2��g����H=+131.3kJ/mol��
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����abef��
a���������ƽ����Է����������ٸı� b������ѹǿ���ٸı�
c��������Ũ����� d����Ӧ��ϵ���¶ȱ��ֲ���
e�����������������Ƕ�����������ʵ�2�� f�������ǰ�ܶȲ���
g����λʱ���ڣ�����ˮ������������������������Ϊ9��1
��2���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״������в�����Ҫ��Ӧ���£�
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-58kJ/mol
�����ƶϸ÷�Ӧ�Է����е�����Ϊ���ڸ÷�Ӧ��S��0����H��0���ʸ��ݡ�G=��H-T��S��0����Ӧ�Է������жϸ÷�Ӧ�ڵ��������Է����У�
������1 mol CO2��2 mol H2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ�����ߢ��Ӧ��ƽ�ɳ�����С��ϵΪK����K�����������=������������5 min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ0.06mol/��L��min�������¶��µ�ƽ�ⳣ��Ϊ450���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���d��
a�������¶� b��ʹ�ú��ʵĴ��� c������He d����ԭ�����ٳ���CO2��H2
��CH4ȼ�ϵ�������ʺܸߣ�װ��������1L 2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���2.24Lʱ�����缫��ӦΪCH4-8e-+10OH-=CO32-+7H2O��
 ��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
��ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ����1����֪��H2O��g��=H2O��l����H=44KJ/mol
| ���� | H2��g�� | C��s�� | CO��g�� |
| ȼ����KJ/mol | 285.8 | 393.5 | 283.0 |
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����abef��
a���������ƽ����Է����������ٸı� b������ѹǿ���ٸı�
c��������Ũ����� d����Ӧ��ϵ���¶ȱ��ֲ���
e�����������������Ƕ�����������ʵ�2�� f�������ǰ�ܶȲ���
g����λʱ���ڣ�����ˮ������������������������Ϊ9��1
��2���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״������в�����Ҫ��Ӧ���£�
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-58kJ/mol
�����ƶϸ÷�Ӧ�Է����е�����Ϊ���ڸ÷�Ӧ��S��0����H��0���ʸ��ݡ�G=��H-T��S��0����Ӧ�Է������жϸ÷�Ӧ�ڵ��������Է����У�
������1 mol CO2��2 mol H2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ�����ߢ��Ӧ��ƽ�ɳ�����С��ϵΪK����K�����������=������������5 min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ0.06mol/��L��min�������¶��µ�ƽ�ⳣ��Ϊ450���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���d��
a�������¶� b��ʹ�ú��ʵĴ��� c������He d����ԭ�����ٳ���CO2��H2
��CH4ȼ�ϵ�������ʺܸߣ�װ��������1L 2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���2.24Lʱ�����缫��ӦΪCH4-8e-+10OH-=CO32-+7H2O��
13��25��ʱ���й����ʵĵ���ƽ�ⳣ�������
��1���������ǿ����˳��ΪH2SO3��CH3COOH��H2CO3���û�ѧʽ��ʾ����ͬ����
��2�������£�0.02mol•L-1��CH3COOH��Һ�ĵ����ԼΪ3%�����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ�ߣ����ߣ����������������=������
��3����������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С��˳��ΪCO32-��SO32-��CH3COO-��HSO3-��
��4��NaHSO3��Һ�����Ե�ԭ��HSO3-?H++SO32-��HSO3-+H2O?H2SO3+OH-��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����NaHSO3��Һ�����ԣ����ӷ���ʽ���ʵ�����������������Һ������Ũ���ɴ�С�Ĺ�ϵ��C��Na+����C��HSO3-����C��H+����C��SO32-����C��OH-����
| ��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
| ����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��2�������£�0.02mol•L-1��CH3COOH��Һ�ĵ����ԼΪ3%�����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ�ߣ����ߣ����������������=������
��3����������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С��˳��ΪCO32-��SO32-��CH3COO-��HSO3-��
��4��NaHSO3��Һ�����Ե�ԭ��HSO3-?H++SO32-��HSO3-+H2O?H2SO3+OH-��HSO3-�ĵ���̶ȴ�����ˮ��̶ȣ�����NaHSO3��Һ�����ԣ����ӷ���ʽ���ʵ�����������������Һ������Ũ���ɴ�С�Ĺ�ϵ��C��Na+����C��HSO3-����C��H+����C��SO32-����C��OH-����
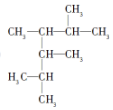 2��3��4��5-�ļ�����
2��3��4��5-�ļ�����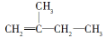 2-��-1-��ϩ
2-��-1-��ϩ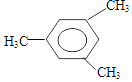 ��
��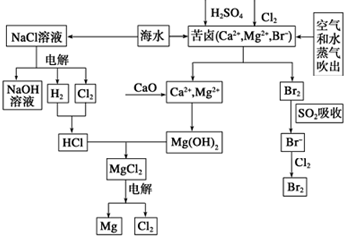 ��ˮ�DZ������Դ���⣬Ŀǰ�ȼҵ����ˮ��þ����ˮ����Ϊ�����ṩ�˴�����ҵԭ�ϣ���ͼ�Ǻ�ˮ�ۺ����õIJ�������ͼ����ͼ�ش����⣺
��ˮ�DZ������Դ���⣬Ŀǰ�ȼҵ����ˮ��þ����ˮ����Ϊ�����ṩ�˴�����ҵԭ�ϣ���ͼ�Ǻ�ˮ�ۺ����õIJ�������ͼ����ͼ�ش����⣺