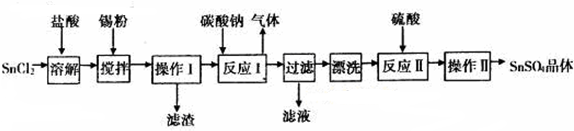
题目内容
3.辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难.辉铜矿的湿法冶炼目前国内外都处于探索阶段.自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如图所示: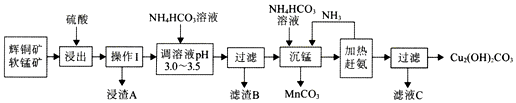
已知:
①辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等.
②软锰矿的主要成分是MnO2,含有较多的SiO2等.
③浸出时,生成一种非金属单质.
④室温下,Kap[Fe(OH)3]=4.0×10-8mol/L,Kap[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是增大与酸的接触面积,加快反应速率(或提高浸出效率).
(2)写山浸出时主要反应的离子方程式Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O.
(3)浸渣A的主要成分为SiO2、S;调溶液pH 3.0-3.5的目的是除去Fe3+离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=4.
(4)工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2.
(5)从滤液C中提取硫酸氨晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干操.
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有实现资源的综合利用、不产生污染环境的气体、能耗低等.(列举其中2条)
分析 流程分析可知辉铜矿软锰矿加入硫酸酸浸:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2不溶,过滤得到浸渣A为S、SiO2,得到浸出液调节溶液PH,使铁离子全部沉淀,滤渣B为氢氧化铁,过滤得到浸出液中主要含有CuSO4、MnSO4等,加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩,冷却结晶过滤洗涤干燥得到硫酸氨晶体,据此分析作答.
解答 解:(1)浸出前需要先将矿石粉碎,增大与酸的接触面积,加快反应速率(或提高浸出效率);
故答案为:增大与酸的接触面积,加快反应速率(或提高浸出效率);
(2)浸出时,二氧化锰有氧化性,将Cu2S氧化生成铜离子和硫单质,反应为:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;
故答案为:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;
(3)浸出时,二氧化锰不溶,生成的硫单质不溶,故浸渣A为SiO2、S;调溶液pH 3.0-3.5,将Fe3+以氢氧化物的形式除去; 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,c(Fe3+)=4.0×10-8mol/L,则c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-8}}}$=10-10mol/L,则c(H+)=10-4mol/L,pH=4;
故答案为:SiO2、S;Fe3+;4;
(4)MnCO3在空气中受热制取MnO2,反应为:2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2;
故答案为:2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2;
(5)滤液C经过蒸发浓缩,冷却结晶过滤洗涤干燥得到晶体;
故答案为:蒸发浓缩 冷却结晶;
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿实现资源的综合利用、不产生污染环境的气体、能耗低等;
故答案为:实现资源的综合利用、不产生污染环境的气体、能耗低等.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为CO32->SO32->CH3COO->HSO3-.
(4)NaHSO3溶液显酸性的原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 甲烷(乙烯) | 溴水 | 洗气 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低 | |
| C. | 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 |