题目内容
17.2016年10月17日,我国神舟11号飞船发射在即,长征三号丙型运载火箭开始加注燃料.长征三号丙型火箭第一级和第二级采用偏二甲肼(UDMH)和N2O4为动力源,反应方程式为:(CH3)2N2H2+2N2O4=2CO2+4H2O+3N2,关于该反应的说法中正确的是( )| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
分析 N2O4在反应中N元素化合价由+4价降低到0价,为氧化剂,(CH3)2N2H2在反应中C、N元素化合价升高,被氧化,为还原剂,以此解答该题.
解答 解:N2O4在反应中N元素化合价由+4价降低到0价,为氧化剂,(CH3)2N2H2在反应中C、N元素化合价升高,被氧化,为还原剂,氮气既是氧化产物也是还原产物,
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握元素化合价的判断,为解答该题的关键,难度不大.

练习册系列答案
相关题目
9.下列实验装置或操作与微粒的大小无直接关系的是( )
| A. |  | B. |  | C. |  | D. |  |
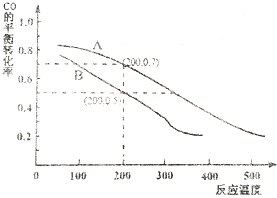
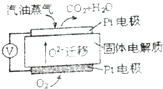
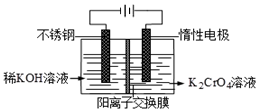 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: