题目内容
13.氮、磷及其化合物在科研及生产中均有着重要的应用.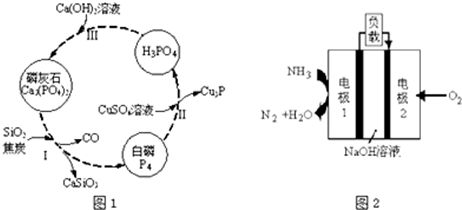
(1)室温下,浓度均为0.1mol/L的亚硝酸(HNO2)、次氯酸两种溶液,它们的电离常数Ka分别为:7.1×10-4、2.98×10-8.将0.1mol/L的亚硝酸稀释,c(H+)将减小(填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)不变.写出涉及HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的化学方程式HNO2+NaClO=NaNO2+HClO.
(2)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性.已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因NH2OH+H2O?[NH3OH]++OH-.
(3)磷及部分重要化合物的相互转化如图1所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是作还原剂.
②不慎将白磷沾到皮肤上,可用CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(4)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,溶液中c(Ca2+)=5×10-6mol•L-1.(已知Ksp[Ca3(PO4)2]=2×10-29)
(5)某液氨-液氧燃料电池示意图如图2,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol•L-1,则该过程中需要氨气的质量为1.7g.(假设溶液电解前后体积不变)
分析 (1)稀释促进弱电解质的电离,平衡常数只与温度有关;由 Ka可知酸性的强弱,结合强酸制取弱酸的反应原理分析;
(2)一水合氨电离显碱性,结合NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似可知,电离生成氢氧根离子;
(3)①2Ca3(PO4)2+6SiO2+10C=P4↑+6CaSiO3+10CO↑中,C元素的碳化合价升高;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,结合电子守恒计算;
(4)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,结合Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29计算;
(5)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、4NH3+3O2=2N2+6H2O,结合转移电子守恒计算.
解答 解:(1)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关,与浓度无关,Ki值不发生变化,由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换,反应的化学方程式为:HNO2+NaClO=NaNO2+HClO,
故答案为:减小;不变;HNO2+NaClO=NaNO2+HClO;
(2)羟胺和水反应生成[NH3OH]+和OH-,发生电离方程式为NH2OH+H2O?[NH3OH]++OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,
故答案为:NH2OH+H2O?[NH3OH]++OH-;
(3)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C=P4↑+6CaSiO3+10CO↑,反应中C元素的碳化合价升高,作还原剂,
故答案为:作还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=0.05mol,
故答案为:0.05;
(4)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29,c(Ca2+)=$\root{3}{\frac{2×1{0}^{-29}}{(4×1{0}^{-7})^{2}}}$=5×10-6mol•L-1,
故答案为:5×10-6;
(5)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,设生成0.15molNaOH转移电子的物质的量为x,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
2mol:2mol=0.15mol:x,
x=0.15mol,
串联电路中转移电子物质的量相等,且液氨-液氧燃料电池的效率为50%,则液氨失电子的物质的量为0.3mol,
设消耗氨气的质量为y,
4NH3+3O2=2N2+6H2O 转移电子
68g 12mol
y 0.3mol
68g:12mol=y:0.3mol,y=1.7g,
故答案为:1.7g.
点评 本题考查较综合,涉及弱电解质的电离、氧化还原反应计算等,为高频考点,把握习题中的信息、反应原理的应用等为解答的关键,注意守恒法应用,侧重分析与计算能力的综合考查,题目难度中等.

| A. | v(A2)=1.5 mol/(L•s) | B. | v(B2)=2.4 mol/(L•s) | C. | v(C)=1.6 mol/(L•s) | D. | v(A2)=6 mol/(L•min) |
| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)由实验Ⅰ确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |

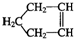 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;