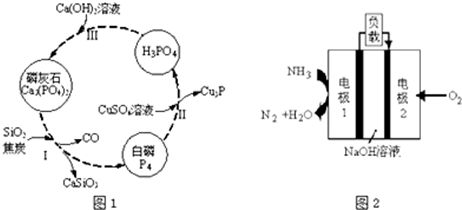
题目内容
8.在Na+的物质的量浓度为0.5mol•L-1的某澄清溶液中,还可能含有如表中所示的若干种离子.| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)由实验Ⅰ确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
分析 由题意知溶液为澄清溶液,因此溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为$\frac{\frac{0.56L}{22.4L/mol}}{0.1L}$=0.25mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为$\frac{\frac{2.4g}{60g/mol}}{0.1L}$=0.4mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)=2×0.25mol/L+2×0.4mol/L=1.3mol/L>0.5mol/L,因此溶液中一定含有K+,且其浓度至少为0.8mol/L,不能确定NO3-是否存在.
解答 解:由题意知溶液为澄清溶液,因此溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为$\frac{\frac{0.56L}{22.4L/mol}}{0.1L}$=0.25mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为$\frac{\frac{2.4g}{60g/mol}}{0.1L}$=0.4mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)=2×0.25mol/L+2×0.4mol/L=1.3mol/L>0.5mol/L,因此溶液中一定含有K+,且其浓度至少为0.8mol/L,不能确定NO3-是否存在.
(1)由实验Ⅰ可知,加入足量稀盐酸生成白色沉淀并在标准状况下放出0.56L气体,则该溶液中一定含有CO32-、SiO32-,则一定没有Ag+、Mg2+、Ba2+,
故答案为:Ag+、Mg2+、Ba2+;
(2)实验Ⅰ中生成沉淀的离子方程式为:SiO32-+2H+=H2SiO3↓,
故答案为:SiO32-+2H+=H2SiO3↓;
(3)通过上述分析计算可知,
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
故答案为:存在,其浓度至少为0.8mol/L.
点评 本题考查离子共存等,难度中等,注意掌握离子反应,根据电荷守恒判断K+是否存在,是本题的难点、易错点,难度中等.

| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 分子式是C3H8O的所有同分异构体共3种 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,不可用水浴加热控制反应的温度 | |
| D. | 迷迭香酸结构如图: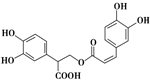 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 1 mol 迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
| X | ||
| Y | Z |
(2)X的最高价氧化物的化学式为CO2,X元素的最简单气态氢化物的分子式为CH4.
(3)Z的最高价氧化物是两性(选填“两性”“酸性”或“碱性”)氧化物.
(4)Y与水反应的化学方程式2Mg+2H2O═Mg(OH)2+H2↑.
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成 |

 氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题: .
.