题目内容
15.现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体.回答下列问题:(1)A分别与B、C形成的最简单化合物中,稳定性H2O>NH3(用分子式表示),其中A与B形成的最简单化合物分子的空间构型为三角锥形;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为
 .
.(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1:1,则丙中含有的化学键类型是离子键和共价键(或非极性共价键);
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈酸性(填“酸”、“碱”或“中”),用离子方程式解释原因NH4++H2O?NH3.H2O+H+;
(5)写出实验室制取单质E的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
分析 A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),则A为H元素,D为Na元素;C与A、B、D均能形成多种常见化合物,可知C为O元素;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,盐为硝酸铵,可知B为N元素;化合物AE常温下为气体,可知E为H元素,然后结合元素化合物知识来解答.
解答 解:A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),则A为H元素,D为Na元素;C与A、B、D均能形成多种常见化合物,可知C为O元素;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,盐为硝酸铵,可知B为N元素;化合物AE常温下为气体,可知E为H元素,
(1)非金属性O>N,则氢化物稳定性为H2O>NH3,A与B形成的最简单化合物分子为氨气,含1对孤对电子,3个N-H共价键,其空间构型为 三角锥形,
故答案为:H2O;NH3;三角锥形;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,均显碱性,组成元素的原子数目比均为1:1:1,其中乙是某种家用消毒液的有效成分,则乙为NaClO,甲为NaOH,化合物甲的电子式为 ,
,
故答案为: ;
;
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1:1,则丙为Na2O2,含有的化学键类型是离子键和共价键(或非极性共价键),
故答案为:离子键和共价键(或非极性共价键);
(4)B元素的最高价氧化物对应的水化物为硝酸,其氢化物为氨气,二者反应生成的盐为硝酸铵,水解呈酸性,用离子方程式解释原因为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;
(5)实验室制取单质E的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意化学键、周期律及水解原理的应用,题目难度不大.


| A. | H2O分子中H-O的键能为462kJ?mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ?mol-1 | |
| C. | H2的燃烧热为240 kJ?mol-1 | |
| D. | 欲分解2molH2O(l),至少需要提供4×462kJ的热量 |
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
①G→Q十NaCl
②Q+H2O$\stackrel{电解}{→}$X+H2
③Y十NaOH→G十Q十H2O
④Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
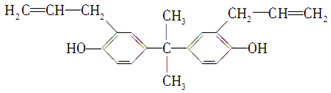
| A. | 该化合物属于芳香烃 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 双酚A不能使溴水褪色,但能使酸性高锰酸钾溶液褪色 | |
| D. | 1 mol双酚A最多可与2 mol H2发生加成反应 |