题目内容
20.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):①G→Q十NaCl
②Q+H2O$\stackrel{电解}{→}$X+H2
③Y十NaOH→G十Q十H2O
④Z十NaOH→Q十X十H2O
这五种化合物中氯的化合价由低到高的顺序为( )
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
分析 G、Q、X、Y、Z均为氯的含氧化合物,根据氧化还原反应中Cl元素的化合价升降来分析解答.
解答 解:①G→Q十NaCl中,NaCl中Cl元素为-1价,则Cl元素的化合价为Q>G>-1,
②Q+H2O$\stackrel{电解}{→}$X+H2中,H元素的化合价降低,则Cl元素的化合价升高,所以Cl元素的化合价为X>Q,
③Y十NaOH→G十Q十H2O中,结合(1)可知Cl元素的化合价为Q>Y>G,
④Z十NaOH→Q十X十H2O中,结合(3)可知,Cl元素的化合价为X>Z>Q,
所以五种化合物中氯的化合价由低到高的顺序为GYQZX,
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确氧化还原反应中元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
相关题目
11.已知在101kPa,25℃条件下,2mol氢气燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
8.下列有关实验原理或操作正确的是( )
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
12.下列说法正确的是( )
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g C2H4O2所含共用电子对数目为7NA | |
| B. | 1L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 1mol甲基或氨基所含电子数均为9NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
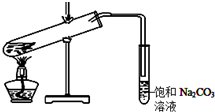 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示. .
.