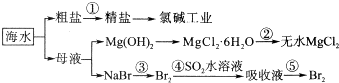
题目内容
3.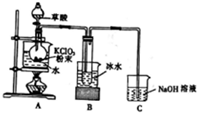 二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O.装置A中还需使用的玻璃仪器是温度计,其作用是
控制水浴加热温度为60℃.
(2)装置B用冰水浴的原因是常温下二氧化氯为气态,用冰水将其冷凝为液态,以防爆炸.
(3)实验过程中,装置C的溶液中除了会产生少量Na2CO3外还会生成等物质的量的另外两种钠盐,其中一种为
NaClO2,则另一种钠盐的化学式为NaClO3.
(4)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,请补充从NaClO2溶液中制得NaClO2•3H2O的操作步骤:
a.(减压)蒸发浓缩;
b.低于38℃时冷却结晶.
c.过滤、洗涤;
d.干燥.
(5)工业上常用原酸或双氧水还原氯酸钠制备ClO2,用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
分析 实验流程为在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极易爆炸,制取和使用二氧化氯时要用性质确定的气体如氮气稀释,以防爆炸,并利用NaOH吸收含ClO2的尾气,防止环境污染,据此分析解题;
(1)装置A中氯酸钾与草酸(中强酸)反应得到二氧化氯,并同时生成K2CO3和CO2等,可根据质量守恒和原子守恒书写方程式;反应需要控制温度为60℃,测定仪器为温度计;
(2)装置B用冰水浴的目的是降温,使ClO2液化,防止气态ClO2爆炸;
(3)用NaOH吸收含有ClO2的尾气,产生之一为NaClO2,可见发生了氧化还原反应,可结合电子守恒和原子守恒判断产物;
(4)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,故从NaClO2溶液中制得NaClO2•3H2O需要在低温下进行,可选择减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;
(5)盐酸或双氧水均能还原氯酸钠制备ClO2,但H2O2的氧化产物为O2,而盐酸的氧化产物为氯气,对环境有污染,据此判断选择.
解答 解:实验流程为在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极易爆炸,制取和使用二氧化氯时要用性质确定的气体如氮气稀释,以防爆炸,并利用NaOH吸收含ClO2的尾气,防止环境污染.
(1)装置A中氯酸钾与草酸(中强酸)反应制备二氧化氯,发生反应的化学方程式为2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;可利用温度计测定水浴温度,达到控制温度为60℃的目的,故答案为:2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;温度计;控制水浴加热温度为60℃;
(2)保用装置B的目的是为防止气态ClO2爆炸,利用冰水浴降温,使ClO2液化,故答案为:常温下二氧化氯为气态,用冰水将其冷凝为液态,以防爆炸;
(3)用NaOH吸收ClO2,产物NaClO2为还原产物,根据氧化还原反应的本质,另一产物为氧化产物,NaClO2中氯为+3,从+4到+3降1价,则氧化产物从+4升高一价为+5价,此时得到的二种产物才等物质的量,也满足电子守恒,即所得产物为NaClO3,故答案为:NaClO3;
(4)防止析出的晶体是NaClO2,采用减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;故答案为:(减压)蒸发浓缩;低于38℃时冷却结晶;
(5)H2O2的氧化产物为O2,盐酸的氧化产物为氯气,对环境有污染,则选择用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
点评 本题是物质制备实验探究分析,考查制备原理分析、混合物的分离提纯、实验条件选择等,属基础考查,对提高学生分析问题解决问题的能力有促进作用,难度适中.

| A. | c(C2O42-)<0.64c(CO32-) | B. | c(CO32-)>1.56c(C2O42-) | ||
| C. | c(C2O42-)<1.56c(CO32-) | D. | c(C2O42-)>0.64c(CO32-) |
(1)三氮化铵水解可生成氨气和物质X,X的结构式为
 .
.(2)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,断裂1mol N≡N键需要的能量为946kJ.

(3)常温下,向amol•L-1的氨水加入等体积bmol•L-1的盐酸,混合溶液呈中性,则该温度下氨水的电离平衡常数为$\frac{b×1{0}^{-7}}{a-b}$(用含a和b的代数式表示).
(4)相同温度下,向甲、乙、丙三个容积相同的恒容密闭容器中按照下列三种方式分别投料,发生反应:N2(g)+3H2(g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
| N(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
②达到平衡时,甲、乙、丙三个容器中NH3的体积分数由大到小的顺序为丙>甲=乙.
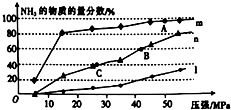
(5)现分别在150℃、300℃、500℃时向反应器中接n(N2):n(H2)=1:3投料发反应:N2(g)+3H2(g)?2NH3(g),该反应达到平衡时,体系中NH3的物质的量分数随压强的变化曲线如图所示.
①150℃时发生的反应可用曲线m(填“m”、“n”或“l”)表示.
②上图中A、B、C三点的平衡常数K的大小关系是K(B)=K(C)<K(A).
③若B点时c(NH3)=0.6mol•L-1,则此时反应的化学平衡常数K=44.4.
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |

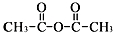
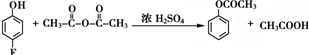 .
.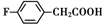 、
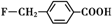
、
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.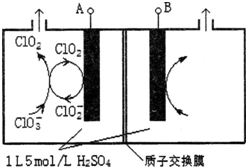 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.