题目内容
13.已知1mol NaOH与HCl完全反应放出57.4kJ的热量.下列热化学方程式书写正确的是( )| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
分析 已知1mol NaOH与HCl完全反应生成1mol水放出57.4kJ的热量,中和反应是放热反应,反应焓变为负值,据此发信息判断选项.
解答 解:已知1mol NaOH与HCl完全反应生成1mol水放出57.4kJ的热量,中和反应是放热反应,反应焓变为负值,则AC错误,B中反应放出热量错误,正确的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,
故选D.
点评 本题考查了酸碱反应热化学方程式书写方法,主要是反应焓变、物质聚集状态的理解应用,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列图示与对应的叙述相符的是( )
| A. | 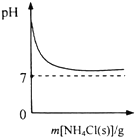 表示向NH3•H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化 | |
| B. | 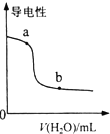 表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:b>a | |
| C. | 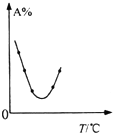 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)?B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0 | |
| D. | 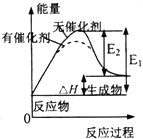 表示催化剂能改变化学反应的焓变 |
4.化学与社会、环境和生活密切相关.下列说法正确的是( )
| A. | 食盐、食醋和味精是常用的食品添加剂,其主要成分均属钠盐 | |
| B. | SO2、CO2、NO2均被列入我国空气质量报告的指标 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 家用84消毒液可用来漂白衣物,为了增强其漂白效果,使用时可加入浓盐酸 |
1.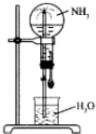 四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )
四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )
 四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )
四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①=②>③>④ |
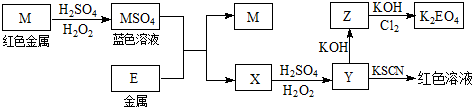
2.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
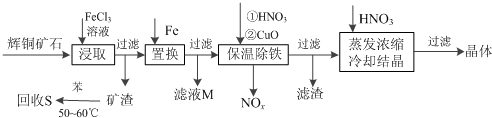
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
(1)写出浸取过程中Cu2S溶解成Cu2+的离子方程式Cu2S+4Fe3+=2Cu2++4Fe2++S.
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移的电子数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| C. | 在30g二氧化硅晶体中含有的共价键数目为2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,其体积约为22.4L |