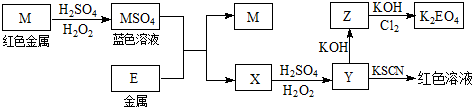
题目内容
3.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )| A. | 24g Mg变为Mg2+时失去的电子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 常温常压下,22 g氧气和26 g臭氧所含氧原子总数为3 NA | |
| D. | 18 g重水(D2O)所含电子数为10NA |
分析 A.质量转化为物质的量,结合1个镁失去2个电子生成+2价镁离子;
B.氦气为单原子分子;
C.根据n=$\frac{m}{M}$计算物质的量;
D.根据质量、摩尔质量、分子数、电子数、阿伏伽德罗常数之间的关系式计算判断.
解答 解:A.24g镁物质的量是1mol,变成镁离子失去2mol电子,失去的电子数为2NA,故A正确;
B.含有NA个氦原子的氦气,物质的量为1mol,标准状况下的体积约为22.4L,故B正确;
C.氧气和臭氧都是由氧原子构成,氧原子总质量为22+26=48g,所以含有氧原子个数:$\frac{48g}{16g/mol}$=3mol,含氧原子总数为3 NA,故C正确;
D.每个D2O分子中含有10个电子,但18gD2O的物质的量小于1mol,所以18gD2O含有的电子数小于10NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的计算应用,主要考查质量换算物质的量计算微粒数,掌握以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
13.如图装置可用来监测空气中NO的含量,下列说法不正确的是( )


| A. | 电子由Pt电极流出,经外电路流向NiO电极 | |
| B. | Pt电极上发生的是还原反应 | |
| C. | NiO电极的电极反应式为NO+O2--2e-═NO2 | |
| D. | 每转移2 mol电子,有1 mol O2-迁移到负极 |
11.银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | |
| B. | 如果有1mol电子转移,就有32.5g Zn参加反应 | |
| C. | 原电池工作时,正极区PH减小 | |
| D. | 锌为阳极,Ag2O为阴极 |
13.工业甲醛(HCHO)含量测定的一种方法是:在甲醛的水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定,(已知H2O2也能氧化甲酸HCOOH)
①HCHO+H2O2→HCOOH+H2O△H<0
②NaOH+HCOOH→HCOONa+H2O△H<0
下列有关说法正确的是( )
①HCHO+H2O2→HCOOH+H2O△H<0
②NaOH+HCOOH→HCOONa+H2O△H<0
下列有关说法正确的是( )
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量一定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化等物质的量甲醛(反应①)和甲酸时转移电子的数目相同 |







 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
. .
. .
.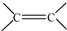 和
和 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).