题目内容
1.下列离子方程式书写不正确的是( )| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
分析 A.生成的是氢氧化铁胶体,不能使用沉淀符号;
B.锌与稀硫酸反应生成硫酸锌和氢气;
C.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
D.氯化铁与氢氧化钾反应生成氢氧化铁沉淀和氯化钾.
解答 解:A.制备Fe(OH)3胶体时需要加热,且生成的不是沉淀,正确的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A错误;
B.H2SO4溶液中投入锌粒,反应生成硫酸锌和氢气,反应的离子方程式为:2H++Zn═H2↑+Zn2+,故B正确;
C.用NaHCO3 治疗胃酸过多,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故C正确;
D.氯化铁和氢氧化钾溶液混合,二者反应生成氢氧化铁沉淀和氯化钾,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓,故D正确;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
11.在容积不变的密闭容器中通入一定量的A发生反应:2A(g)?B(g)+C(g)△H>0.T1温度下的部分实验数据为:
下列说法正确的是( )
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
12.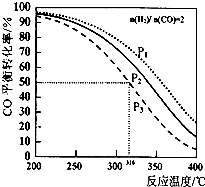 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
6.下列实验设计方案中,可行的是( )
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
13.下列描述不涉及化学变化的是( )
| A. | 铁粉作袋装食品的抗氧化剂 | B. | 二氧化硫作纸浆的漂白剂 | ||
| C. | 氢氟酸作普通玻璃的刻蚀剂 | D. | 有机溶剂作食用油的萃取剂 |
10.向含有a mol Na2CO3的溶液中通入b molHCl,下列说法不正确的是( )
| A. | 当b>2a时,发生的离子反应为:CO32-+2H+=H2O+CO2↑ | |
| B. | 当b<a时,发生的离子反应为:CO32-+H+=HCO3- | |
| C. | 当4a=3b时,发生的离子反应为:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 当a<b<2a时,反应生成的HCO3-与CO2的物质的量之比为(b-a):(2b-a) |
1. 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |