题目内容
1.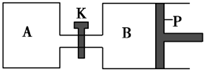 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |
分析 A为恒容容器,B是恒压容器,反应2A2(g)+B2(g)?2C(g)发生以后,气体的物质的量之和减小,所以B相当于在A的基础上加压,所以平衡B对于A而言是加压了,向右移动,C的浓度增大,放出的热量增加,以此解答该题.
解答 解:A.反应的方程式为2A2(g)+B2(g)?2C(g),可知反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$,故A正确;
B.平衡B对于A而言是加压了,向右移动,C的浓度增大,所以w1<w2,故B错误;
C.方程式中a是2mol A2和1mol B2气体完全反应,平衡B对于A而言是加压了,向右移动,C的浓度增大,放出的热量增加,所以a>c>b,故C正确;
D.打开K后,因为B端压强的大于A端的压强,所以B中压强会减小,活塞P会向左移动,故B的体积减小,故D正确.
故选B.
点评 本题综合考查化学平衡的问题,涉及化学平衡常数、影响化学反应速率、化学平衡移动的因素等知识,综合性强,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
9.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在0min~3min 内,各物质物质的量的变化如表所示:
已知2min内 v(Q)=0.075mol•L-1•min-1,且 v(z):v(Y)=1:2
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.
13.某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4•5H2O.工艺流程如下(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤.
II.向滤液中滴加H2O2溶液,稍加热.
III.向II的溶液中加入CuO粉末至pH=4.
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1.
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体.
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
(1)II中发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)II中将Fe2+氧化为Fe3+的目的是在调节在pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀.
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化.
(4)III中发生反应的离子方程式是2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+.
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全(提示:当溶液中某离子浓度小于1.0×10-5 mol•L-1时可认为该离子沉淀完全).
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因用稀硫酸酸化至PH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体
(6)V中获得晶体的方法是蒸发浓缩、冷却结晶.
I.取工业硫酸铜固体,用稀硫酸溶解,过滤.
II.向滤液中滴加H2O2溶液,稍加热.
III.向II的溶液中加入CuO粉末至pH=4.
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1.
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体.
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 |
(2)II中将Fe2+氧化为Fe3+的目的是在调节在pH=4时,只将Fe3+转化为沉淀除去,而不会使Cu2+转化为沉淀.
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是若有蓝色沉淀生说,说明Fe2+没有完全转化;若没有蓝色沉淀生成,说明Fe2+已经完全转化.
(4)III中发生反应的离子方程式是2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+.
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全(提示:当溶液中某离子浓度小于1.0×10-5 mol•L-1时可认为该离子沉淀完全).
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因用稀硫酸酸化至PH=1,可以抑制Cu2+在加热过程中水解,以获得纯净的硫酸铜晶体
(6)V中获得晶体的方法是蒸发浓缩、冷却结晶.
10. 硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
 硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )| A. | 该反应在高温时比低温更易自发进行 | |
| B. | 曲线I上A、C两点反应速率的关系是:vA<vC | |
| C. | T0时该反应的平衡常数为160 | |
| D. | 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则II是Fe2O3作催化剂的曲线 |
11.某同学需要用到85mL 1mol/L的NaCl溶液,现需在实验进行配制,填空并请回答下列问题:
(1)配制1mol/L的NaCl溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAED;
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.定容时,继续向容量瓶内小心加水到溶液离刻度线1-2cm,改用胶头滴管逐滴滴加水到凹液面恰好与刻度线相切
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度偏低;
②若定容时俯视刻度线偏高;
③C操作中不小心洒出有溶液偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点重新配制.
(1)配制1mol/L的NaCl溶液
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.定容时,继续向容量瓶内小心加水到溶液离刻度线1-2cm,改用胶头滴管逐滴滴加水到凹液面恰好与刻度线相切
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度偏低;
②若定容时俯视刻度线偏高;
③C操作中不小心洒出有溶液偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点重新配制.
