题目内容
12.(1)通常用来衡量一个国家的石油化学工业发展水平的标志是A年产量.A、乙烯 B、乙炔 C、乙醇 D、乙烷
(2)写出下列反应的化学方程式,注明反应类型:
①实验室制取乙酸乙酯:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;反应类型酯化反应(或取代反应)
②由苯乙烯制取聚苯乙烯:
 ;反应类型加聚反应.
;反应类型加聚反应.
分析 (1)乙烯用来衡量一个国家的石油化学工业发展水平;
(2)①乙酸与乙醇发生酯化反应生成乙酸乙酯、水;
②苯乙烯中含碳碳双键,可发生加聚反应生成聚苯乙烯.
解答 解:(1)乙烯用来衡量一个国家的石油化学工业发展水平,故答案为:A;
(2)①乙酸与乙醇发生酯化反应生成乙酸乙酯、水,反应为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,属于酯化反应(或取代反应),
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应(或取代反应);
②苯乙烯中含碳碳双键,可发生加聚反应生成聚苯乙烯,反应为 ,属于加聚反应,
,属于加聚反应,
故答案为: ;加聚反应.
;加聚反应.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
2.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的电子式是: .
.
(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:

(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
17.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:Br->Cl->F-
④稳定性:HCl>H2S>PH3.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:Br->Cl->F-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
2.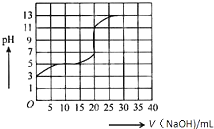 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
 .
.
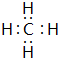 ;
;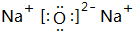 ;
;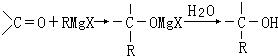
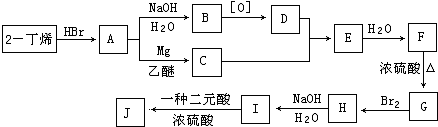
 .
. ,
,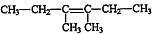 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$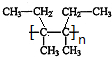 .
.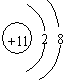 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.