题目内容
2. 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )| A. | 通电后,阳极附近pH增大 | |
| B. | 电子从负极经电解质溶液回到正极 | |
| C. | 通电后,A-通过阴离子交换膜从阴极进入浓缩室 | |
| D. | 当电路中通过2mol电子的电量时,会有1mol的O2生成 |
分析 与电源正极相连的是电解池的阳极,与电源负极相连的是电解池的阴极,用惰性电极电解,电解质溶液中的阴阳离子放电,据此分析,
A.氢氧根离子在阳极上失电子发生氧化反应,氢离子浓度增大;
B.电子不能通过溶液;
C.阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-?HA,乳酸浓度增大;
D.根据阳极反应式4OH--4e-═2H2O+O2↑计算.
解答 解:A.氢氧根离子在阳极上失电子发生氧化反应,氢离子浓度增大,PH值减小,故A错误;
B.电子不能通过溶液,故B错误;
C.阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,则A-通过阴离子交换膜从阴极进入浓缩室,故C正确;
D.阳极反应式4OH--4e-═2H2O+O2↑,所以当电路中通过2mol电子的电量时,会有0.5mol的O2生成,故D错误;
故选:C.
点评 本题涉及电解池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等,注意把握有离子交换膜时离子的移动方向.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
13.钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的是
( )
( )
| A. | 其单质的熔点比钠的熔点低 | B. | 在空气中燃烧只能生成Fr2O | ||
| C. | 其原子半径在同一主族中是最大的 | D. | 氧化物对应的水化物的碱性很强 |
10.我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如图所示,下列说法正确的是( )
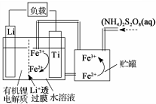

| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
17.下列有机物在核磁共振氢谱上有两组峰的是( )
| A. | 甲酸乙酯 | B. | 2-甲基丙烯酸乙酯 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 2-氯-2-甲基丙醛 |
7.分子式为C9H12属于芳香烃的有机物共有(不含立体异构)( )
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.X2+和Y-与氖的电子层结构相同,下列判断正确的是( )
| A. | 原子半径:Y>X | B. | 原子序数:Y>X | ||
| C. | 电子层数:Y>X | D. | 最外层电子数:Y>X |
18.在常温常压下,10ml硫化氢气体和一定体积的氧气混合点燃,反应后恢复至原状态,余下15mL气体,则反应前氧气的体积为( )
| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |