题目内容
18.在常温常压下,10ml硫化氢气体和一定体积的氧气混合点燃,反应后恢复至原状态,余下15mL气体,则反应前氧气的体积为( )| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |
分析 可能发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O或2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,常温下水为液体,则余下15mL气体为氧气或二氧化硫和氧气的混合气体,以此计算.
解答 解:若发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O剩余气体为氧气,参加反应的氧气为10mL×$\frac{1}{2}$=5mL,反应前氧气的体积为15ml+5mL=20mL;
若发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,二氧化硫和氧气的混合气体,参加反应的氧气为10mL×$\frac{3}{2}$=15mL,生成二氧化硫为10mL,反应前氧气的体积为15ml+5mL=20mL,故反应前氧气的体积为20mL.
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及剩余气体的成分为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2. 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )| A. | 通电后,阳极附近pH增大 | |
| B. | 电子从负极经电解质溶液回到正极 | |
| C. | 通电后,A-通过阴离子交换膜从阴极进入浓缩室 | |
| D. | 当电路中通过2mol电子的电量时,会有1mol的O2生成 |
9.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 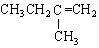 2-甲基丁烯 2-甲基丁烯 | D. | 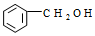 苯甲醇 苯甲醇 |
6.下列各组物质,前者是混合物,后者是纯净物的是( )
| A. | 胆矾 玻璃 | B. | 汽油 液氯 | C. | 石油 盐酸 | D. | 干冰 铝热剂 |
13.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
3.烯烃A与氢气加成后的生成物是2,2-二甲基丁烷,则A的名称是( )
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-1-丁烯 | ||
| C. | 3,3-二甲基-1-丁烯 | D. | 3,3-二甲基-2-丁烯 |

 (填写电子式).
(填写电子式).