题目内容
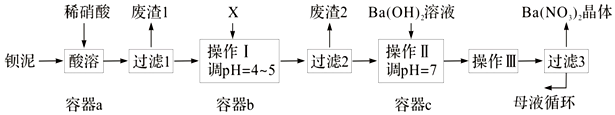
10.我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如图所示,下列说法正确的是( )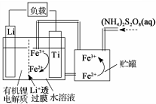
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
分析 该电池的负极是金属锂,离子交换膜至于许离子经过,不允许分子经过,在负极上是金属锂失电子的氧化反应,电极反应式为:Li-e-=Li+,正极上是铁离子得电子的还原反应,即Fe3++e-=Fe2+,两极反应相加,可得到总反应,在二次电池充电时,原电池的负极和电源的负极相连,原电池的正极和电源的负极相连,以此解答该题.
解答 解:A.该电池的负极是金属锂,Li+透过膜除允许Li+通过,不允许H2O分子通过,故A错误;
B.放电时,正极上得电子的还原反应,即Fe3++e-=Fe2+,Fe2+与S2O82-发生氧化还原反应,S2O82-+2Fe2+=2Fe3++2SO42-,以补充S2O82-,故B正确;
C.钛电极是电池的正极,充电时,应该与外电源的正极相连,故C错误;
D.电池反应为Li+Fe3+=Li++Fe2+,则充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+,故D错误.
故选B.
点评 本题考查学生原电池和电解池的工作原理知识,为高频考点,侧重考查学生的分析能力,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
1.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
5.NH3•H2O分子中NH3与H2O之间氢键表示为( )(填序号)
| A. | N-H••O | B. | O-H…N | C. | H-N…N | D. | H-O…H |
2. 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )| A. | 通电后,阳极附近pH增大 | |
| B. | 电子从负极经电解质溶液回到正极 | |
| C. | 通电后,A-通过阴离子交换膜从阴极进入浓缩室 | |
| D. | 当电路中通过2mol电子的电量时,会有1mol的O2生成 |
6.下列各组物质,前者是混合物,后者是纯净物的是( )
| A. | 胆矾 玻璃 | B. | 汽油 液氯 | C. | 石油 盐酸 | D. | 干冰 铝热剂 |