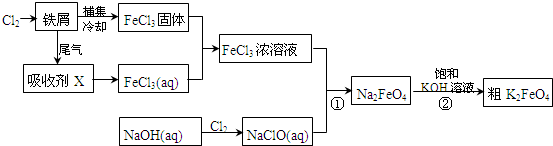
题目内容
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含VI A族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)硫离子结构示意
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列
(3)O、S、Se原子的第一电离能由大到小的顺序为
(4)Se原子基态核外电子的排布式为
(5)SO32-离子中硫原子的杂化方式
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂.其立方晶体的晶胞结构如图所示,则该氧化物的化学式为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)S为16号元素,得到2个电子形成硫离子;
(2)根据晶体类型判断,一般原子晶体熔沸点最高,分子晶体熔沸点最低;
(3)根据第一电离能递变规律判断,同主族元素从上到下第一电离能逐渐减小;
(4)根据原子序数和微粒间作用力判断;
(5)根据价键互斥理论判断;
(6)根据均摊法进行计算.
(2)根据晶体类型判断,一般原子晶体熔沸点最高,分子晶体熔沸点最低;
(3)根据第一电离能递变规律判断,同主族元素从上到下第一电离能逐渐减小;
(4)根据原子序数和微粒间作用力判断;
(5)根据价键互斥理论判断;
(6)根据均摊法进行计算.
解答:
解:(1)硫离子核外有18个电子,结构示意图为 ,故答案为:
,故答案为: ;
;
(2)(2)SiO2为原子晶体,熔沸点取决于共价键键能,熔沸点很高;Na2O为离子晶体,熔沸点取决于其晶格能,熔沸点较高;P2O5为分子晶体,熔沸点取决于分子间作用力,熔沸点较低,故答案为:SiO2>Na2O>P2O5;
(3)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,故答案为:O>S>Se;
(4)Se原子序数为34,根据能量最低原则、泡利不相容原理和洪特规则Se原子基态核外电子的排布式为1s22s22p63s23p63d104s24p4或[Ar]3dl04s24p4;二者均由分子构成,熔沸点取决于分子间作用力,分子间作用力取决于相对分子质量,H2Se的相对分子质量比H2S大,因此H2Se分子间作用力强于H2S;
故答案为1s22s22p63s23p63d104s24p4或[Ar]3dl04s24p4;H2Se分子间作用力强于H2S;
(5))SO32-离子价电子对数为
=4,形成4条新的杂化轨道,采用了sp3杂化;孤电子对数=价电子对数-配位原子数=4-3=1,含有一对孤对电子,占据一条杂化轨道,对S-O键有排斥作用,S与O构成三角锥形,故答案为:sp3;三角锥形;
(6)在晶胞结构中,黑颜色球代表的微粒位于体内,共4个;白颜色球代表的微粒8个位于顶点和6个位于面心,个数为8×
+6×
=4,化学式可写为AO,故答案为:AO.
 ,故答案为:
,故答案为: ;
;(2)(2)SiO2为原子晶体,熔沸点取决于共价键键能,熔沸点很高;Na2O为离子晶体,熔沸点取决于其晶格能,熔沸点较高;P2O5为分子晶体,熔沸点取决于分子间作用力,熔沸点较低,故答案为:SiO2>Na2O>P2O5;
(3)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,故答案为:O>S>Se;
(4)Se原子序数为34,根据能量最低原则、泡利不相容原理和洪特规则Se原子基态核外电子的排布式为1s22s22p63s23p63d104s24p4或[Ar]3dl04s24p4;二者均由分子构成,熔沸点取决于分子间作用力,分子间作用力取决于相对分子质量,H2Se的相对分子质量比H2S大,因此H2Se分子间作用力强于H2S;
故答案为1s22s22p63s23p63d104s24p4或[Ar]3dl04s24p4;H2Se分子间作用力强于H2S;
(5))SO32-离子价电子对数为
| 6+2 |
| 2 |
(6)在晶胞结构中,黑颜色球代表的微粒位于体内,共4个;白颜色球代表的微粒8个位于顶点和6个位于面心,个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题综合考查物质结构与性质,涉及核外电子排布规律、电离能、杂化理论、分子结构、晶胞结构等,其中判断空间构型容易出错.

练习册系列答案
相关题目
把7.4g Na2CO3?10H2O和NaHCO3组成的混合物溶于水,配成100mL溶液,其中c(Na+)=0.6mol?L-1.若把等质量的混合物加热到恒重时,残留物的质量是( )
| A、3.18 g |
| B、2.21 g |
| C、5.28 g |
| D、4.22 g |
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
下列四组物质中,两种分子中不具有相同核外电子总数的是:
| A、H2O2和CH3OH |
| B、H2O和CH4 |
| C、NHO2和HClO |
| D、H2S和F2 |
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入4mol?L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是( )
| A、参加反应的硝酸是0.4mol |
| B、消耗氧气的体积为1.68 L |
| C、此反应过程中转移的电子为0.3 mol |
| D、混合气体中含NO21.12 L |
 在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.
在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.