题目内容
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入4mol?L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是( )
| A、参加反应的硝酸是0.4mol |
| B、消耗氧气的体积为1.68 L |
| C、此反应过程中转移的电子为0.3 mol |
| D、混合气体中含NO21.12 L |
考点:有关混合物反应的计算
专题:计算题
分析:标况下2.24L混合气体的物质的量为:
=0.1mol;50mL 4mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:4mol/L×0.05L=0.2mol,
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,再根据氮原子守恒可得硝酸的物质的量;
B.生成氢氧化铜的物质的量为:0.2mol×
=0.1mol,反应消耗的铜的物质的量为0.1mol,0.1mol铜完全反应失去0.2mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,根据电子守恒计算出消耗氧气物质的量,再计算出其体积;
C.根据B的分析可知反应转移的电子的物质的量;
D.设NO的物质的量为x、二氧化氮的物质的量为y,分别根据总体积、电子守恒列式计算.
| 2.24L |
| 22.4L/mol |
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,再根据氮原子守恒可得硝酸的物质的量;
B.生成氢氧化铜的物质的量为:0.2mol×
| 1 |
| 2 |
C.根据B的分析可知反应转移的电子的物质的量;
D.设NO的物质的量为x、二氧化氮的物质的量为y,分别根据总体积、电子守恒列式计算.
解答:
解:标况下2.24L混合气体的物质的量为:
=0.1mol;50mL 4mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:4mol/L×0.05L=0.2mol,
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,根据氮原子守恒可得硝酸的物质的量为:0.1mol+0.2mol=0.3mol,故A错误;
B.生成氢氧化铜的物质的量为:0.2mol×
=0.1mol,反应消耗的铜的物质的量为0.1mol,0.1mol铜完全反应失去0.2mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,则消耗氧气的物质的量为:
=0.05mol,消耗标况下氧气的体积为:22.4L/mol×0.05mol=1.12L,故B错误;
C.根据B的分析可知,反应转移的电子为0.2mol,故C错误;
D.设NO的物质的量为x、二氧化氮的物质的量为y,则x+y=0.1,根据电子守恒可得:3x+y=0.2,解得:x=0.05mol、y=0.05mol,所以混合气体中二氧化氮的体积为1.12L,故D正确;
故选D.
| 2.24L |
| 22.4L/mol |
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,根据氮原子守恒可得硝酸的物质的量为:0.1mol+0.2mol=0.3mol,故A错误;
B.生成氢氧化铜的物质的量为:0.2mol×
| 1 |
| 2 |
| 0.2mol |
| 4 |
C.根据B的分析可知,反应转移的电子为0.2mol,故C错误;
D.设NO的物质的量为x、二氧化氮的物质的量为y,则x+y=0.1,根据电子守恒可得:3x+y=0.2,解得:x=0.05mol、y=0.05mol,所以混合气体中二氧化氮的体积为1.12L,故D正确;
故选D.
点评:本题考查了有关离子反应的计算,题目难度中等,明确铜过量及发生反应原理为解答关键,转移电子守恒、质量守恒在化学计算中的应用方法.

练习册系列答案
相关题目
天然所的主要成分为CH4.1molCH4的质量为( )
| A、16g | B、16 |
| C、32g | D、16g/mol |
化学知识在日常生活中有很多应用,下列说法正确的是( )
| A、用食盐清洗热水瓶中的水垢 |
| B、漂白粉在空气中容易变质的原因是Ca(ClO)2见光分解 |
| C、加碘食盐,能使淀粉显蓝色 |
| D、氯水应避光保存,是因为HClO见光分解 |
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含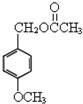 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: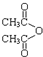 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式: