题目内容
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
考点:氧化还原反应
专题:氧化还原反应专题
分析:含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数以及元素化合价的变化来分析氧化剂与还原剂的物质的量之比,以此解答.
解答:
解:A.O3+2KI+H2O=2KOH+I2+O2中,氧元素的化合价降低,碘元素的化合价升高,则O3为氧化剂,KI为还原剂,氧化剂与还原剂的物质的量之比为1:2,故A正确;
B.属于复分解反应,不是氧化还原反应.故B错误;
C.I2+2NaClO3=2NaIO3+Cl2中,氯元素的化合价降低,碘元素的化合价升高,则NaClO3为氧化剂,I2为还原剂,氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O中Cl元素化合价升高,被氧化,为还原剂,Mn元素化合价降低,MnO2做氧化剂,由方程式可知,HCl在反应中表现为酸性和还原性,氧化剂与还原剂的物质的量之比为1:2,故D正确.
故选AD.
B.属于复分解反应,不是氧化还原反应.故B错误;
C.I2+2NaClO3=2NaIO3+Cl2中,氯元素的化合价降低,碘元素的化合价升高,则NaClO3为氧化剂,I2为还原剂,氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O中Cl元素化合价升高,被氧化,为还原剂,Mn元素化合价降低,MnO2做氧化剂,由方程式可知,HCl在反应中表现为酸性和还原性,氧化剂与还原剂的物质的量之比为1:2,故D正确.
故选AD.
点评:点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确利用元素的化合价变化来分析氧化剂、还原剂时解答的关键,选项中的A是学生解答的易错点,难度不大.

练习册系列答案
相关题目
下列离子方程式中书写正确的是( )
| A、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| B、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ |
| C、铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ |
| D、硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液.通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变)( )
| A、1.25 mol?L-1 |
| B、2.5 mol?L-1 |
| C、0.50 mol?L-1 |
| D、1.0 mol?L-1 |
下列化学式中,能真实表示物质的分子组成的是( )
| A、NaOH |
| B、Li2O |
| C、Ar |
| D、KMnO4 |
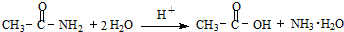
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含
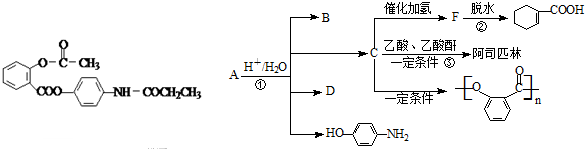
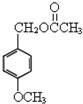 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: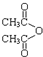 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式: