题目内容
2.下列说法正确的是( )| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
分析 影响化学反应速率的因素有内因和外因,物质的性质为内因,为影响化学反应速率的主要因素,外因有温度、浓度、压强、催化剂等,其中催化剂只改变反应速率,但不能概念反应的方向,以此解答该题.
解答 解:A.化学平衡状态时,正逆反应速率相等但不等于0,故A错误;
B.催化剂不能使不能发生反应的物质发生反应,只改变反应速率,故B错误;
C.水不可能使水变成油,不符合质量守恒定律,故C错误;
D.温度越高,反应速率越快,所以锌与稀硫酸反应时,适当提高溶液的温度可加快反应速率,故D正确.
故选D.
点评 本本题考查化学反应速率的影响因素,为高频考点和常见题型,注意把握内因和外因的区别,特别是催化剂的性质,为该题考查的侧重点,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
3.从科学的角度来看,下列说法正确的是( )
| A. | 冬天用煤炉取暖,为防止热量散失,应关紧门窗 | |
| B. | 进入古井前,应先做灯火试验 | |
| C. | 一次性塑料袋使用方便又经济,应大力提倡生产 | |
| D. | 油锅不慎着火,应立即用大量的水冲灭 |
10.为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体.
已知:①N2 (g)+O2 (g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3 (g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
则反应4NH3(g)+6NO(g)?5N2 (g)+6H2O(g)的△H是( )
已知:①N2 (g)+O2 (g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3 (g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
则反应4NH3(g)+6NO(g)?5N2 (g)+6H2O(g)的△H是( )
| A. | +2.98 kJ•mol-1 | B. | -2.98 kJ•mol-1 | ||
| C. | +1807.98 kJ•mol-1 | D. | -1807.98 kJ•mol-1 |
7.现有四种元素的基态原子的电子排布式如下
①1s22s1
②1s22s2
③1s22s22p1
④1s22s22p5
则下列有关比较中正确的是( )
①1s22s1
②1s22s2
③1s22s22p1
④1s22s22p5
则下列有关比较中正确的是( )
| A. | 第一电离能:④>②>③>① | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:④>③>①>② | D. | 最高正化合价:④>③>②>① |
14.短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X 元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )
| A. | W的简单氢化物稳定性比Z的简单氢化物稳定性低 | |
| B. | Y与W形成的化合物YW2的熔点高、硬度大 | |
| C. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| D. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y |
11.下列实验方案设计不能达到预期目的是( )
| A. | 向氯酸钾溶液中加入硝酸银溶液和稀硝酸,检验氯酸钾中的氯元素 | |
| B. | 铜可溶于浓硫酸却不溶于稀硫酸,证明浓硫酸的氧化性更强 | |
| C. | 氢氧化铝能分别跟强酸和强碱反应,说明氢氧化铝是两性氢氧化物 | |
| D. | 通过测溶液的pH,鉴别NH4Cl、NaCl、K2CO3三种溶液 |
12.下列表达式正确的是( )
| A. | 甲烷的结构式 CH4 | B. | 乙烯的结构式 | ||
| C. | 乙烯的结构简式C2H4 | D. | 四氯化碳的电子式: |
 中和热的测量,是一个重要的定量实验.
中和热的测量,是一个重要的定量实验. .
.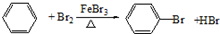 ,反应类型:取代反应.
,反应类型:取代反应.