题目内容
10.为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体.已知:①N2 (g)+O2 (g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3 (g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
则反应4NH3(g)+6NO(g)?5N2 (g)+6H2O(g)的△H是( )
| A. | +2.98 kJ•mol-1 | B. | -2.98 kJ•mol-1 | ||
| C. | +1807.98 kJ•mol-1 | D. | -1807.98 kJ•mol-1 |
分析 ①N2(g)+O2(g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
根据盖斯定律,①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g),由此分析解答.
解答 解:①已知①N2(g)+O2(g)=2NO(g);△H=+180.50kJ•mol-l
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.48kJ•mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1807.98kJ/mol,
故选:D.
点评 本题考查盖斯定律在反应热计算中的应用,题目难度中等,注意掌握盖斯定律的概念,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
11.2012年7月21日,北京地区突降近60年最大的暴雨,造成水灾.为确保大灾之后无大疫,当地防疫部门使用了含氯类消毒剂,其中ClO2是一种消毒杀菌效率较高的消毒剂,有强氧化性.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化制得.则有关此反应的说法正确的是( )
| A. | NaClO3是还原剂 | |
| B. | 氧化性:ClO2>NaClO3 | |
| C. | 化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O | |
| D. | 1 mol NaClO3参加反应有2 mol e-转移 |
18.下列反应属于取代反应的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 苯与液溴在催化剂作用下生成溴苯 | |
| C. | 乙烯与氢气在催化剂作用下生成乙烷 | |
| D. | 乙醇在铜催化、加热条件下与氧气反应 |
5.下列解释事实的离子方程式不正确的是( )
| A. | 粗铜精炼时,阴极质量增加:Cu2++2e-═Cu | |
| B. | 明矾可用作净水剂:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用食醋除去水壶中的水垢(CaCO3):2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq) |
2.下列说法正确的是( )
| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
19.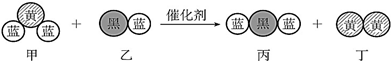 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )| A. | 甲、乙、丙、丁中有3 种非极性分子 | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | H2CO3、HNO3的相对强弱与分子中键的极性相关 | |
| D. | N2O5的水化物中不存在氢键 |
20.下列各组离子在溶液中能够大量共存的是( )
| A. | H+、Fe2+、Na+、NO3- | B. | NH4+、NO3-、Na+、SO42- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SiO32- |
