题目内容
11.下列实验方案设计不能达到预期目的是( )| A. | 向氯酸钾溶液中加入硝酸银溶液和稀硝酸,检验氯酸钾中的氯元素 | |
| B. | 铜可溶于浓硫酸却不溶于稀硫酸,证明浓硫酸的氧化性更强 | |
| C. | 氢氧化铝能分别跟强酸和强碱反应,说明氢氧化铝是两性氢氧化物 | |
| D. | 通过测溶液的pH,鉴别NH4Cl、NaCl、K2CO3三种溶液 |
分析 A.氯酸钾不能电离出氯离子,用硝酸银溶液无法检验氯元素;
B.浓硫酸能够溶解铜而稀硫酸不与铜反应,证明浓硫酸具有强氧化性;
C.能够与强酸、强碱溶液反应的氢氧化物为两性氢氧化物;
D.氯化铵溶液呈酸性,氯化钠溶液呈中性,碳酸钾溶液呈碱性.
解答 解:A.氯酸钾在溶液中电离出钾离子和硫酸根离子,向氯酸钾溶液中加入硝酸银溶液和稀硝酸,不会生成沉淀,该方法无法检验氯酸钾中的氯元素,故A错误;
B.铜可溶于浓硫酸却不溶于稀硫酸,能够证明浓硫酸的氧化性更强,故B正确;
C.氢氧化铝既能够与强酸反应,又能够与强碱溶液反应,则氢氧化铝是两性氢氧化物,故C正确;
D.NH4Cl、NaCl、K2CO3三种溶液分别呈酸性、中性和碱性,所以可通过测溶液的pH鉴别三种溶液,故D正确;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、浓硫酸性质、物质鉴别等知识,明确常见元素及其化合物性质为解答关键,A为易错点,注意氯酸钾不能电离出氯离子,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法正确的是( )
| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
19.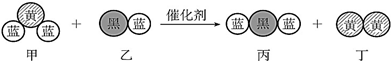 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )| A. | 甲、乙、丙、丁中有3 种非极性分子 | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | H2CO3、HNO3的相对强弱与分子中键的极性相关 | |
| D. | N2O5的水化物中不存在氢键 |
6.下列离子在溶液中能常量共存的是( )
| A. | K+ H+ Fe2+ NO3- | B. | H+ Al3+ SO42- Cl- | ||
| C. | Na+ Al3+ HCO3- Cl- | D. | Na+ NH4+ OH- CO32- |
16.已知一些金属单质的发现、使用与金属的活动性存在着某种必然联系,下列时间或事件发生在铁器时代之前的是( )
| A. | 电解氧化铝获得铝 | B. | 戴维发现金属钠 | ||
| C. | 青铜器时代 | D. | 锌铸币的出现 |
3.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
| A. | CaCl2、Na2CO3 | B. | Ba(OH)2、NaHSO4 | C. | AlCl3、NH3•H2O | D. | Al2(SO4)3、NaOH |
20.下列各组离子在溶液中能够大量共存的是( )
| A. | H+、Fe2+、Na+、NO3- | B. | NH4+、NO3-、Na+、SO42- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SiO32- |
1.某化合物6.4克在氧气中完全燃烧,只生成8.8克CO2和7.2gH2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳氢原子个数比为1:2 | ||
| C. | 该化合约中一定含有氧元素 | D. | 若要确定其分子式一定需要质谱仪 |
