题目内容
4.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.(1)提出假设 ①该反应的气体产物是CO2.
②该反应的气体产物是CO.
③该反应的气体产物是CO2、CO的混合物.
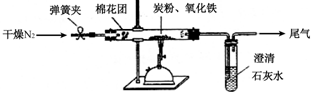
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气.
请写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2,其作用分别为步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收.
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑.
(6)实验优化 学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M(BaCO3)>M(CaCO3),称量时相对误差小.
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯或增加一尾气处理装置.
分析 (1)根据过量炭粉与氧化铁反应的气体产物可能有①CO、②CO2、③CO2、CO的混合物得出假设③;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)⑤根据前后两次通入氮气的时间和减小实验误差角度来分析;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)①根据氢氧化钙和氢氧化钡的本质区别进行分析;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物,则假设③为:CO2、CO的混合物,
故答案为:CO2、CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O,
故答案为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(4)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气,最后确保完全吸收,反应后还要赶出所有的CO2,
故答案为:步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收;
(5)3.20g氧化铁的物质的量为=$\frac{3.2g}{160g/mol}$=0.02mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=$\frac{2.0g}{100g/mol}$=0.02mol,m(CO2)=0.02mol×44g/mol=0.88g,
反应后硬质玻璃管和固体总质量变化为1.44g大于0.88g,则生成其气体为CO2、CO的混合物,混合气体中含有CO0.08mol,所以CO、CO2的混合气体物质的量比为4:1,所以方程式为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑,
故答案为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑;
(6)①将澄清石灰水换成Ba(OH)2溶液的理由是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小,
故答案为:Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃进行尾气处理,
故答案为:在尾气出口处加一点燃的酒精灯或增加一尾气处理装置.
点评 本题主要考查的是物质组成与含量的测定、性质实验方案的设计,题目难度中等,涉及离子反应方程式、化学方程式书写、环境保护、实验方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验、化学计算能力.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | 不慎将酸溅到眼中,应立即用碱液冲洗,边洗边眨眼睛 | |
| B. | 酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 | |
| C. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入食盐,过滤 | |
| D. | 常温下,准确称取14.8g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 |
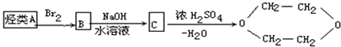
| A. | 乙烯 | B. | 乙醇 | C. | 乙二醇 | D. | 乙酸 |
| A. | 准确量取24.00 mL的液体可选用量筒或滴定管 | |
| B. | 配制0.1000mol•L-1碳酸钠溶液时,将溶液转移到容量瓶中需用玻璃棒引流 | |
| C. | 用广泛pH试纸测得某溶液pH为3.5 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| A. | 放电时,电极A为负极 | |
| B. | 根据上表数据,请你判断该电池工作的适宜温度应控制在350℃~2050℃ | |
| C. | 放电时,Na+的移动方向为从电极A到电极B | |
| D. | 充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS |
| A. | 将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | |
| B. | CH3COOH 溶液加水稀释后,溶液中c(H+)/c(CH3COO-) 的值减小 | |
| C. | 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) |
| A. | 氯化氢 | B. | 石墨 | C. | NaCl溶液 | D. | 蔗糖 |
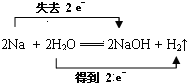 反应中,H2O是氧化剂.
反应中,H2O是氧化剂.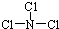 ,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.
,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.