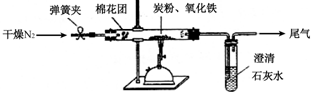
题目内容
14.下列物质中,属于电解质的是( )| A. | 氯化氢 | B. | 石墨 | C. | NaCl溶液 | D. | 蔗糖 |
分析 电解质是在水溶液中或熔融状态下能导电的化合物,在水溶液中和熔融状态下均不能导电的化合物为非电解质,据此分析.
解答 解:A、HCl在水溶液中能导电,故为电解质,故A正确;
B、石墨是单质,既不是电解质也不是非电解质;
C、NaCl溶液是混合物,既不是电解质也不是非电解质,故C错误;
D、蔗糖在水溶液中和熔融状态下均不能导电,故为非电解质,故D错误.
故选A.
点评 本题考查了电解质、非电解质的判别,应注意的是单质和混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
5.化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适 宜的物质 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
2.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | H2SO4 | B. | Cl2 | C. | NaAlO2 | D. | NH3 |
9.如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).
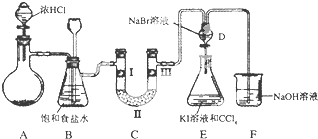
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入d;
(提示:硅胶是干燥剂,不与氯气反应)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-,若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是E中液体分为两层,下层(CCl4层)为紫红色.

(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入d;
(提示:硅胶是干燥剂,不与氯气反应)
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
19.用BaCl2检验SO42-离子时,先在待测溶液中加入盐酸,其作用是( )
| A. | 形成较多的白色沉淀 | |
| B. | 排除SO42-以外的其它阴离子及Ag+的干扰 | |
| C. | 形成的沉淀纯度更高 | |
| D. | 排除Ba2+以外的其它阳离子的干扰 |
6.在相同的温度下,已知反应:
①N2(g)+O2(g)?2NO(g)的平衡常数K=3.84×10-31;
②2SO2(g)+O2(g)?2SO3(g)的平衡常数K=3.10×1025.
则在该温度下,两个化学反应的反应程度之间的关系为( )
①N2(g)+O2(g)?2NO(g)的平衡常数K=3.84×10-31;
②2SO2(g)+O2(g)?2SO3(g)的平衡常数K=3.10×1025.
则在该温度下,两个化学反应的反应程度之间的关系为( )
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
13.某温度下,在体积为2L的密闭容器中充入1mol A和b mol B气体,发生如下反应:A(g)+B(g)?2C(g),5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示.下列叙述正确的是( )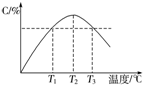

| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |