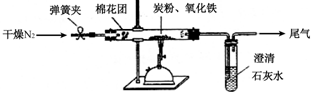
题目内容
13.A、B、C 是中学化学中常见的三种短周期元素.已知:①A 元素原子最外层电子数是次外层电子数的2 倍;②B元素最高正价与最低负价的代数和为2;③C 元素有多种化合价,且常温下C 元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C 两种元素质子数之和是A 元素质子数的4 倍.(1)写出C的单质和强碱溶液反应的离子方程式Cl2+2OH-═Cl-+ClO-+H2O.
(2)意大利罗马大学的FuNvio Cacace 等人获得了极具理论研究意义的B4 气态分子.B4 分子结构与白磷分子结构相似,已知断裂1mol B-B 吸收167kJ 的热量,生成1mol B≡B 放出942kJ 热量.试写出由B4 气态分子变成B2气态分子的热化学方程式:N4(g)═2N2(g)△H=-882 kJ/mol.
(3)由B、C 两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C 两种原子最外层均达到8个电子的稳定结构.X 遇水蒸气可形成一种常见的漂白性物质.则X 的结构式为
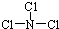 ,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.
,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.(4)B2H4 是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:H2B-BH2+H2O??H2N-NH3++OH-(或N2H5++OH-).
分析 A、B、C是中学化学中常见的三种短周期元素,①A元素原子最外层电子数是次外层电子数的2倍,元素最外层电子数不超过8,则其次外层是K层,则A是C元素;②B元素最高正价与最低负价的代数和为2,处于VA族,③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物,考虑C为Cl,④B、C两种元素质子数之和是A元素质子数的4倍,则B为N元素,据此解答.
解答 解:A、B、C是中学化学中常见的三种短周期元素,①A元素原子最外层电子数是次外层电子数的2倍,元素最外层电子数不超过8,则其次外层是K层,则A是C元素;②B元素最高正价与最低负价的代数和为2,处于VA族,③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物,考虑C为Cl,④B、C两种元素质子数之和是A元素质子数的4倍,则B为N元素.
(1)氯气与碱反应生成氯离子和次氯酸根离子和水,离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)B为氮元素,断裂1molN-N吸收167kJ的热量,生成1molN≡N放出942kJ热量,则N4(g)═2N2(g)的△H=167×6kJ/mol-2×942kJ/mol=-882 kJ/mol,反应热化学方程式为:N4(g)═2N2(g)△H=-882 kJ/mol,
故答案为:N4(g)═2N2(g)△H=-882 kJ/mol;
(3)B为氮元素、C为氯元素,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,则两种元素组成的化合物X为NCl3,结构中存在三个N-Cl共价单键,其结构式为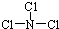 ,由X遇水蒸气可形成一种常见的漂白性物质,该漂白性物质为HClO,反应方程式为:NCl3+3H2O═NH3+3HClO,
,由X遇水蒸气可形成一种常见的漂白性物质,该漂白性物质为HClO,反应方程式为:NCl3+3H2O═NH3+3HClO,
故答案为: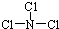 ;NCl3+3H2O═NH3+3HClO;
;NCl3+3H2O═NH3+3HClO;
(4)B2H4为N2H4,水溶液呈弱碱性,是由于其与水中的氢离子结合,同时生成氢氧根离子的原因,即N2H4+H2O?H2N-NH3++OH-(或N2H5++OH-),故答案为:H2N-NH3++OH-(或N2H5++OH-).
点评 本题考查结构性质位置关系应用,推断元素是解题关键,是对所学知识的综合运用,难度中等.

(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ.写出该反应的热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol.
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式②4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=-618.42KJ/mol,.
(3)某温度下纯水中的c(H+)=2×10-7mol/L,则此时c(OH-)=2×10-7mol/L,该纯水的pH<7(填“>7”、“<7”、“=7”).若温度不变,滴入稀硫酸使c(H+)=5×10-6mol/L,则c(OH-)=8×10-9mol/.
(4)(3分)纳米MgO可用于尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究温度对产率的影响 实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | 4:1 | |
| ④ | 398 | 4 | 4:1 |
也可用作有机合成中间体、溶剂等.其制备方法为:

已知(Mr=122)(Mr=150)
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
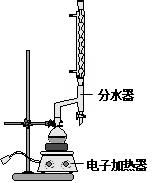
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如右图所示),低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动,从而提高产品产率
(2)反应结束的标志分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶、温度计.
(7)该实验的产率为90%.
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值 | |
| C. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| A. | 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | X与其余三种元素之间形成的核外电子总数为10的微粒只有2种 | |
| D. | H2Z的熔点比H2W高,是因为它们的晶体类型不同 |
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适 宜的物质 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | H2SO4 | B. | Cl2 | C. | NaAlO2 | D. | NH3 |