题目内容
5. 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.(1)写出X原子外围电子排布图:
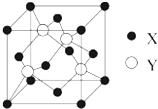
(2)X与Y所形成化合物晶体的晶胞如图所示.该化合物的化学式为ZnS.
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是水分子与乙醇分子之间形成氢键.
(4)Y与Z可形成YZ42-离子,其空间构型为正四面体(用文字描述).写出一种与YZ42-互为等电子体的分子的化学式:CCl4或SiCl4.
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA.
分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素,据此答题;
解答 解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
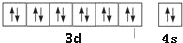
(1)X为Zn,X原子外围电子排布图为 ,
,
故答案为: ;
;
(2)在一个晶胞中,X离子的数目8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Y离子数目为4,该化合物的化学式为ZnS,
故答案为:ZnS;
(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子之间形成氢键;
(4)SO42-中S原子孤电子对数为$\frac{6+2-2×4}{2}$=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4,
故答案为:正四面体;CCl4或SiCl4;
(5)X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂晶胞计算、氢键、配合物、化学键等,注意对基础知识的理解掌握,题目难度中等.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
16.下列对应关系不正确的是( )
| 选项 | A | B | C | D |
| 中心原子所在族 | ⅣA族 | ⅤA族 | ⅣA族 | ⅥA族 |
| 分子通式 | AB4 | AB3 | AB2 | AB2 |
| 立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A. | A | B. | B | C. | C | D. | D |
16.在由水电离出的c(H+)=1×10-12的溶液中可能大量共存的离子组是( )
| A. | NH4+、K+、CO32-、Cl- | B. | Fe3+、K+、SCN-、NO3- | ||
| C. | Al3+、Cu2+、S2-、Cl- | D. | NH4+、Cu2+、Cl-、NO3- |
13.下列晶体熔化时,化学键没有被破坏的是( )
| A. | 碘化钾 | B. | 氯化钠 | C. | 金刚石 | D. | 干冰 |
20.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如图,下列说法正确的是( )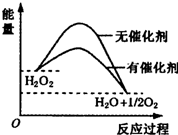

| A. | H2O2分解反应的△H>0 | |
| B. | 催化剂的加入使反应的热效应减小 | |
| C. | 催化剂的加入提高了H2O2的分解率 | |
| D. | 催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率 |
10.下列电离方程式错误的是( )
| A. | CaCl2═Ca2++2Cl- | B. | H2SO4═2H++SO42- | ||
| C. | CH3COOH═CH3COO-+H | D. | KOH═K++OH- |
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 在电解精炼粗铜的过程中,当阴极析出32g铜时转移电子数为NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
