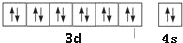
题目内容
20.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如图,下列说法正确的是( )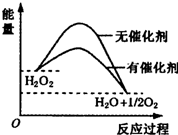
| A. | H2O2分解反应的△H>0 | |
| B. | 催化剂的加入使反应的热效应减小 | |
| C. | 催化剂的加入提高了H2O2的分解率 | |
| D. | 催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率 |
分析 A.图象分析反应是放热反应,反应物的总能量高于生成物的总能量;
B.催化剂只通过改变活化能来改变反应速率;
C.化剂只改变反应速率不改变化学平衡;
D.催化剂在化学反应中可降低反应的活化能以提高反应速率.
解答 解:A.图象分析反应是放热反应,反应物的总能量高于生成物的总能量,△H<0,故A错误;
B.催化剂只通过改变活化能来改变反应速率,不改变反应的热效应,故B错误;
C.催化剂只改变反应速率不改变化学平衡,反应体系中加入催化剂不改变H2O2的平衡转化率,故C错误;
D.催化剂通过降低反应的活化能,来加快正逆反应速率,故D正确.
故选D.
点评 本题考查了化学平衡、化学反应能量的图象分析判断,注意催化剂改变速率不改变平衡的理解,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.关于下列四幅图中相应实验的说法错误的是( )

| A. | 图1中根据电流计(G)指针的偏转方向可比较Zn2+、Cu2+的氧化性强弱 | |
| B. | 图2中根据导气管中液面的变化可以判断铁钉发生了吸氧腐蚀 | |
| C. | 图3中若改用环形铜棒不会影响所测中和热的数值 | |
| D. | 图4中发生反应2NO2(g)?N2O4(g),根据两烧瓶中气体颜色深浅不同可判断其为放热反应 |
11.将1mol NH3和2mol O2混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是( )
| A. | 二氧化氮与氧气 | B. | 硝酸与水 | ||
| C. | 硝酸与一氧化氮 | D. | 一氧化氮与二氧化氮 |
15.下列递变规律正确的是( )
| A. | 酸性 HF>HCl>HBr>HI | B. | 热稳定性 HI>HBr>HCl>HF | ||
| C. | 单质活动性 F2>Cl2>Br2>I2 | D. | 离子还原性 F->Cl->Br->I- |
12.若NA表示阿伏加德罗的数值,下列说法中正确的是( )
| A. | 1molNa作为还原剂可得到的电子数为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数为NA | |
| C. | 常温常压下,4g氦气含有的氦原子数为NA | |
| D. | 1mol Fe与足量的Cl2充分反应电子转移数为2NA |
9. 对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
①加入A;
②加入催化剂;
③加压;
④升温;
⑤减少C
符合图示的条件是( )
 对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
对可逆反应:2A(g)+B(s)?3C(s)+2D(g);△H>0.如图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;
②加入催化剂;
③加压;
④升温;
⑤减少C
符合图示的条件是( )
| A. | ②③ | B. | ①② | C. | ③④ | D. | ④⑤ |
10.将一小块钠投入含有酚酞的水中,观察现象,并解释(表格可不填满)
| 现象 | 解释 |
| 该反应的化学方程式 | |
 (1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ•mol-1.
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ•mol-1.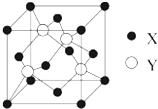 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.