题目内容
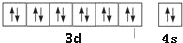
13.下列晶体熔化时,化学键没有被破坏的是( )| A. | 碘化钾 | B. | 氯化钠 | C. | 金刚石 | D. | 干冰 |
分析 化学变化中化学键一定被破坏,共价化合物或离子化合物电离时化学键被破坏,以此来解答.
解答 解:A.碘化钾熔化时,离子键破坏,故A不选;
B.氯化钠熔化时,离子键破坏,故B不选;
C.金刚石熔化,破坏共价键,故C不选;
D.干冰升华,共价键不变,只破坏分子间作用力,故D选;
故选D.
点评 本题考查化学键,为高频考点,把握变化过程中化学键是否变化为解答的关键,注意分子晶体的三态变化只破坏分子间作用力,题目难度中等.

练习册系列答案
相关题目
4.能正确表示下列反应的离子方程式为( )
| A. | 向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 将Na2O2放入H2O中:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| C. | 向NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将稀盐酸与84消毒液混合:C1-+C1O-+2H+═C12↑+H2O |
1.利用下列实验装置能完成相应实验的是( )
| A. |  制取并收集干燥纯净的NH3 | |
| B. |  用装置丁分离乙酸乙酯和饱和碳酸钠溶液 | |
| C. |  用于制备并收集少量NO2 | |
| D. |  比较MnO2、Cl2、S的氧化性 |
2.下列有关实验现象或结论的描述不正确的是( )
| A. | 铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 常温下将5mL 0.1 mol/LNa2S2O3溶液、5mL 0.01 mol/LNa2S2O3溶液分别与5mL 0.1 mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
3.恒温下在密闭容器中进行的反应2SO2+O2?2SO3达到平衡状态的标志是( )
| A. | 容器中SO2、O2、SO3共存 | B. | 容器中SO2 和SO3浓度相同 | ||
| C. | 容器中n(SO2):n(O2):n(SO3)=2:1:2 | D. | 容器中压强不随时间而改变 |
 (1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ•mol-1.
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ•mol-1.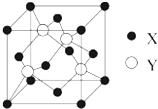 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.