题目内容
15.在如图装置中:
加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D.
(1)写出各物质的化学式A:NaHCO3B:Na2CO3F:O2
(2)按要求写出下列反应的方程式
D与E反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
C与E反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 加热白色固体A(A灼烧时火焰为黄色)生成白色固体B,并放出气体C和D,则A、B含有Na元素,气体D与淡黄色固体E反应,生成固体B和气体F,应是Na2O2与CO2反应生成Na2CO3与O2,可推知D为CO2,E为Na2O2,B为Na2CO3,F为O2,故A为NaHCO3,C为水蒸气,据此进行解答.
解答 解:加热白色固体A(A灼烧时火焰为黄色)生成白色固体B,并放出气体C和D,则A、B含有Na元素,气体D与淡黄色固体E反应,生成固体B和气体F,应是Na2O2与CO2反应生成Na2CO3与O2,可推知D为CO2,E为Na2O2,B为Na2CO3,F为O2,故A为NaHCO3,C为水蒸气,
(1)根据上述分析可知,A为NaHCO3,B为Na2CO3,F为O2,
故答案为:NaHCO3;Na2CO3;O2;
(2)D与E反应为二氧化碳与过氧化钠反应生成碳酸钠与氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
C与E反应为水与过氧化钠的反应,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题为考查了钠的化合物的性质及转化关系、常用化学用语等,题目难度中等,掌握过氧化钠的特殊性质是关键,注意基础知识的理解掌握.

练习册系列答案
相关题目
6.硫酸亚铁铵是一种重要的化工原料,以下各组溶液中加入该盐后,选项中各离子数目均没有明显减少的是( )
| A. | Na+ H+ Cl- NO3- | B. | Na+ Mg2+ Cl- SO42- | ||
| C. | K+ Ba2+ OH- I- | D. | K+ OH- Br- Cl- |
3.恒温下在密闭容器中进行的反应2SO2+O2?2SO3达到平衡状态的标志是( )
| A. | 容器中SO2、O2、SO3共存 | B. | 容器中SO2 和SO3浓度相同 | ||
| C. | 容器中n(SO2):n(O2):n(SO3)=2:1:2 | D. | 容器中压强不随时间而改变 |
10.将一小块钠投入含有酚酞的水中,观察现象,并解释(表格可不填满)
| 现象 | 解释 |
| 该反应的化学方程式 | |
7.下列说法正确的是( )
| A. | 氧化钠可用于呼吸面具中作为氧气的来源 | |
| B. | 氧化还原反应的实质是元素化合价是否变化 | |
| C. | 铁制容器可以贮运稀硝酸 | |
| D. | 雷电为自然界固氮提供了条件 |
9.下列过程只涉及物理变化的是( )
| A. | 臭氧消毒 | B. | 丹桂飘香 | C. | 牛奶变酸 | D. | 食醋除锈 |
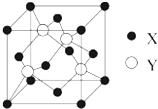 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.