题目内容
下列元素性质的递变规律正确的是( )
| A、原子半径:Be<B<C<N |
| B、第一电离能:B<Be<Mg<Na |
| C、元素的电负性:O>N>S>P |
| D、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A、同一周期元素原子半径从左到右逐渐减小;
B、同一主族元素的第一电离能从上到下逐渐减小,同周期第ⅡA族大于第ⅢA族;
C、同一周期元素从左到右电负性逐渐增大,同一主族元素从上到下电负性逐渐减小;
D、元素非金属性越强,其气态氢化物的稳定性越强.
B、同一主族元素的第一电离能从上到下逐渐减小,同周期第ⅡA族大于第ⅢA族;
C、同一周期元素从左到右电负性逐渐增大,同一主族元素从上到下电负性逐渐减小;
D、元素非金属性越强,其气态氢化物的稳定性越强.
解答:
解:A、同一周期元素原子半径从左到右逐渐减小,因此原子半径Be>B>C>N,故A错误;
B、同一主族元素的第一电离能从上到下逐渐减小,第一电离能:Be>Mg>Na,故B错误.
C、同一周期元素从左到右电负性逐渐增大,因此O>N、S>P,同一主族元素从上到下电负性逐渐减小,因此O>S、N>P,所以电负性:O>N>S>P,一般来说,元素非金属性越强电负性越小,故C正确;
D、元素非金属性越强,其气态氢化物的稳定性越强,非金属性:N>P,C>Si,则气态氢化物的稳定性:NH3>CH4,NH3>PH3,CH4>SiH4,故D错误.
故选:C.
B、同一主族元素的第一电离能从上到下逐渐减小,第一电离能:Be>Mg>Na,故B错误.
C、同一周期元素从左到右电负性逐渐增大,因此O>N、S>P,同一主族元素从上到下电负性逐渐减小,因此O>S、N>P,所以电负性:O>N>S>P,一般来说,元素非金属性越强电负性越小,故C正确;
D、元素非金属性越强,其气态氢化物的稳定性越强,非金属性:N>P,C>Si,则气态氢化物的稳定性:NH3>CH4,NH3>PH3,CH4>SiH4,故D错误.
故选:C.
点评:本题考查了元素周期律的应用,为高考常见题型,难度不大,可根据元素周期律的有关知识进行解答,注意基础知识的积累.

练习册系列答案
相关题目
下列离子方程式错误的是( )
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2 +6H+═2Mn2++5O2↑+8H2O |
| C、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
| D、铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
生活处处有化学.下列说法正确的是( )
| A、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
下列各组混合物,可以用分液漏斗分离的是( )
| A、甲苯和水 | B、甲苯和苯 |
| C、溴乙烷与水 | D、苯与溴乙烷 |
当溶液中X
与H2O2分子个数比为2:5时,溶液中X
离子中X元素恰好被还原为较低价态,则X元素的化合价为( )
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
用下列实验装置进行相应的实验,不能达到实验目的是( )


| A、图Ⅰ所示装置用于实验室制取氨气 |
| B、图Ⅱ所示装置用于制备少量氢气 |
| C、图Ⅲ所示装置用于测定中和反应的反应热. |
| D、图IV所示装置用于证明非金属性强弱S>C>Si |
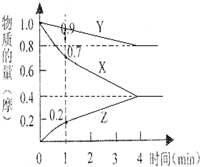 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为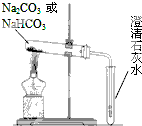 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.