题目内容
 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.(1)碳酸氢钠俗称为
A.苏打 B.纯碱 C.小苏打
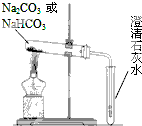
(2)用右图装置分别加热上述两种固体,当观察到澄清石灰水变浑浊时,则试管中加热的固体是
(3)若分别向碳酸钠溶液和碳酸氢钠溶液中滴加足量稀盐酸,都能观察到的现象是
考点:探究碳酸钠与碳酸氢钠的性质
专题:实验设计题
分析:(1)根据碳酸氢钠、碳酸钠的俗名进行解答;
(2)碳酸氢钠不稳定,NaHCO3受热容易分解,而Na2CO3受热不分解,据此进行判断试管中的固体;
(3)二者均与盐酸反应生成二氧化碳,碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳.
(2)碳酸氢钠不稳定,NaHCO3受热容易分解,而Na2CO3受热不分解,据此进行判断试管中的固体;
(3)二者均与盐酸反应生成二氧化碳,碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳.
解答:
解:(1)碳酸氢钠俗称为小苏打,所以C正确;碳酸钠的俗称为纯碱、苏打,所以AB正确,
故答案为:C;AB;
(2)NaHCO3受热易分解,Na2CO3受热不分解,则观察到澄清石灰水变浑浊时,则试管中加热的固体是NaHCO3,
故答案为:NaHCO3;
(3)碳酸钠、碳酸氢钠都与盐酸反应生成二氧化碳气体,所以观察到的现象为:有气泡产生,
故答案为:有气泡产生.
故答案为:C;AB;
(2)NaHCO3受热易分解,Na2CO3受热不分解,则观察到澄清石灰水变浑浊时,则试管中加热的固体是NaHCO3,
故答案为:NaHCO3;
(3)碳酸钠、碳酸氢钠都与盐酸反应生成二氧化碳气体,所以观察到的现象为:有气泡产生,
故答案为:有气泡产生.
点评:本题考查物质的检验和鉴别,把握物质的性质为解答的关键,注意碳酸氢钠、碳酸钠与酸的反应、稳定性,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列关于元素周期律的叙述正确的是( )
| A、元素的性质随着原子序数的递增而呈周期性变化 |
| B、随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 |
| C、随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现 |
| D、元素性质的周期性变化是指相对原子量的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化 |
下列元素性质的递变规律正确的是( )
| A、原子半径:Be<B<C<N |
| B、第一电离能:B<Be<Mg<Na |
| C、元素的电负性:O>N>S>P |
| D、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
下列各组物质用括号内试剂加以鉴别,其中不合理的是( )
| A、Na2CO3溶液和Na2SO4溶液(稀盐酸) |
| B、CO2和H2(澄清石灰水) |
| C、NH4Cl溶液和(NH4)2SO4溶液(氢氧化钡溶液) |
| D、Na2CO3溶液和NaHCO3溶液(氢氧化钙溶液) |
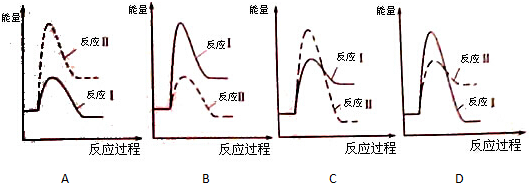
 (g)
(g)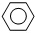 (g)+3H2(g)
(g)+3H2(g)

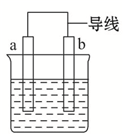 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: