题目内容
5.海水是巨大的化学资源宝库.Ⅰ.从海水中可以提取氯、溴、碘等卤族元素.
(1)HC1的稳定性比HBr强(填写“强”或“弱”).
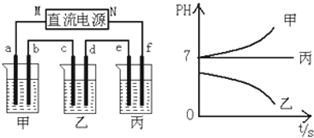
(2)己知:X2(g)+H2(g)?2HX(g)(X2表示Cl2、Br2和I2). 如图1表示平衡常数K与温度t的关系.
①△H表示X2与H2反应的焓变,△H<0.(填“>”、”<”或”=”)
②曲线a表示的是l2(填“Cl2”、“Br2”或“l2”)与H2反应时K与t的关系.
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理.
(1)通常用明矾[K2S04-Al2(S04)3•24H20]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
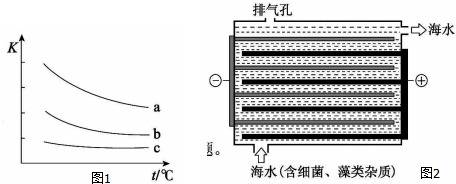
(2)用图2所示NaCl0的发生装置对海水进行消毒和灭藻处理.
①装置中由NaCl转化为NaCl0的化学方程式是2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HC03-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaC03.生成CaC03 的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
分析 Ⅰ.(1)元素的非金属性越强,对应的氢化物越稳定,结合同主族元素的性质的递变规律解答;
(2)依据图象分析平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应;Cl2、Br2、I2,与H2反应时K与t的关系分析可知氯气和氢气反应放热多;
Ⅱ.(1)明矾中含有铝离子,铝离子在水中水解生成氢氧化铝胶体,胶体具有吸附性而净水;
(2)①电解饱和氯化钠溶液反应生成氢氧化钠、氯气和氢气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
②阴极生成氢气,水的电离被破坏电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀;
③阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,酸溶解沉淀.
解答 解:Ⅰ.(1)同主族元素从上到下元素的非金属性逐渐减弱,F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则稳定性HF>HCl>HBr>HI,即HCl的稳定性比HBr强,
故答案为:强;
(2)①图象分析平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,△H<0,
故答案为:<;
②Cl2、Br2、I2,与H2反应时K与t的关系分析可知氯气和氢气反应放热多,碘化氢加热分解平衡逆向进行平衡常数减小的大,曲线a表示的是I2,
故答案为:I2;
Ⅱ.(1)明矾中含有铝离子,铝离子在水中水解生成氢氧化铝胶体,胶体具有吸附性而净水,水解方程式为Al3++3H2O?Al(OH)3(胶体)+3H+;
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(2)①装置中由NaCl转化为NaClO的化学方程式是2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O,
故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;2NaOH+Cl2=NaClO+NaCl+H2O;
②阴极生成氢气,电极附近水的电离被破坏,电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀,氢氧化钠和碳酸氢钙反应生成CaCO3的沉淀产生水垢,生成碳酸钙沉淀的反应离子方程式是:Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
③阴极电解原理分析可知,阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的,
故答案为:阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
点评 本题考查了氢化物的稳定性大小、漂白粉的成份、元素在周期表中位置等,综合性强,掌握基础是关键,注意离子方程式和电极反应的书写方法应用,题目难度中等.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O${\;}_{7}^{2-}$发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.

①中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是使反应物接触更充分,加快反应速率.
(2)“③”中调节pH至4.7,目的是除去溶液中的AlO2-、SiO32-.
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:2CrO42-+2H+?Cr2O72-+H2O.
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-═2I-+S4O62-).
①判断达到滴定终点的依据是:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度(设整个过程中其它杂质不参与反应)83.84%.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
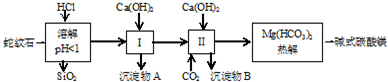
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入过量NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)Mg(HCO3)2热分解的反应方程式为:2 Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg2(OH)2CO3+3CO2↑+H2O.若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数降低(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量为142).
(5)上述实验中,可以循环使用的物质是CO2(填写物质化学式).
(6)除去MgCl2酸性溶液中的Fe3+,可在加热、搅拌的条件下加入MgO或Mg(OH)2或MgCO3(试剂自选),过滤后再加入适量盐酸.
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(1)实验的目的验证第三周期金属元素的金属性的递变规律;
(2)实验内容:与实验方案1-5对应的实验现象依次为E、A、C、B、D(填:字母编号);实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红;
(3)实验结论同周期从左到右元素的金属性逐渐减弱.