题目内容
6.工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量${NH}_{4}^{+}$、Fe3+、${AsO}_{4}^{3-}$、Cl-.为除去杂质离子,部分操作流程如图: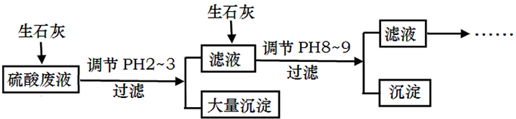
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的密度为4.9g•L-1,则该溶液中的pH约为1.
(2)${NH}_{4}^{+}$在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(${NH}_{4}^{+}$)恰好是NH4Cl溶液中c(${NH}_{4}^{+}$)的2倍,则c[(NH4)2SO4]<c(NH4Cl)(填:<、=或>).
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中$\frac{c({NH}_{3}•{H}_{2}O)}{c({OH}^{-})}$减小(填“增大”、“减小”或“不变”).
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要操作步骤:向沉淀中加入过量稀硫酸,充分反应后,过滤、洗涤、晾干或干燥.
(5)25℃,H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12.当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀.
②Na3AsO4第一步水解的平衡常数数值为:2.5×10-3
③已知:${AsO}_{4}^{3-}$+2I-+2H+═${AsO}_{3}^{3-}$+I2+H2O,SO2+I2+2H2O═${SO}_{4}^{2-}$+2I-+4H+.上述两个反应中还原性最强的微粒是SO2.
分析 硫酸废液中含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,调节pH2~3,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl,
(1)硫酸的浓度为4.9g•L-1,结合c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算;
(2)根据c(NH4+)越大,NH4+水解程度越小判断;
(3)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小;
(4)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,并洗涤、干燥;
(5)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀;
②依据水解常数与电离常数及Kw的关系计算;
③根据还原剂还原性大于还原产物的还原性判断.
解答 解:硫酸废液中含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,调节pH2~3,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],滤液加入生石灰调节pH8~9,生成Ca3(AsO4)2沉淀,滤液主要含有(NH4)2SO4和NH4Cl,
(1)硫酸的浓度为4.9g•L-1,c(H2SO4)=$\frac{\frac{4.9g}{98g/mol}}{1L}$=0.05mol/L,c(H+)=0.1mol/L,pH=-lg0.1=1,故答案为:1;
(2)如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(NH4+)较大,因c(NH4+)越大,NH4+水解程度越小,则(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,则c(NH4Cl)应较大,
故答案为:<;
(3)随着向废液中投入生石灰,c(OH-)增大,c(NH3•H2O)减小,则溶液中$\frac{C(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$减小,故答案为:减小;
(4)提纯CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,过滤后洗涤、干燥,
故答案为:稀硫酸;晾干或干燥;
(5)①H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右,c(AsO43-)增大,Ca3(AsO4)2开始沉淀;
②Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O?HAsO42-+OH-,该步水解的平衡常数Kh=$\frac{c(HAs{{O}_{4}}^{2-})c(O{H}^{-})}{c(As{{O}_{4}}^{3-})}$=$\frac{c(HAs{{O}_{4}}^{2-})c(O{H}^{-})}{c(As{{O}_{4}}^{3-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{{K}_{3}}$=$\frac{1{0}^{-14}}{4.0×1{0}^{-12}}$=2.5×10-3,
故答案为:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.还原剂还原性大于还原产物的还原性,则还原性SO2>I->AsO33-,两个反应中还原性最强的微粒是SO2,
故答案为:SO2.
点评 本题考查较为综合,侧重于学生的分析、实验和计算能力的考查,明确沉淀溶解平衡的溶度积常数、水解常数和电离常数的计算及离子方程式的书写和沉淀的形成等是解本题关键,考查的知识点较多,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(1)实验的目的验证第三周期金属元素的金属性的递变规律;
(2)实验内容:与实验方案1-5对应的实验现象依次为E、A、C、B、D(填:字母编号);实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红;
(3)实验结论同周期从左到右元素的金属性逐渐减弱.
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
①

②

③

④

| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
| A. | CO2 | B. | H2O | C. | NaOH | D. | H2SO4 |