题目内容
10. 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.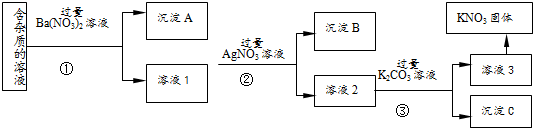
注:KNO3固体受热容易分解
(1)沉淀A的主要成分是BaSO4;BaCO3(填化学式).
(2)②中反应的离子方程式是Ag++Cl-═AgCl↓.
(3)③加入过量的K2CO3溶液的目的是Ba2+、Ag+.
(4)实验室要用450mL 0.40mol/L KNO3溶液配制植物生长液,用实验获得的KNO3固体配制.
①称取KNO3固体的质量是20.2 g.
②某同学转移溶液的操作如右图所示,该同学操作中的错误是没有用玻璃棒引流.
③取100mL 0.40mol/L KNO3溶液加水稀释到400mL,稀释后溶液中NO3-的物质的量浓度为0.10mol/L.
分析 利用含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,得到纯净的KNO3固体,由流程可知,①中加过量的硝酸钡,与K2SO4、K2CO3反应生成沉淀A为BaSO4、BaCO3,滤液中含KCl、硝酸钡、KNO3,②中与过量硝酸银反应生成沉淀B为AgCl沉淀,溶液2中含硝酸钡、硝酸银、硝酸钾,③中与过量碳酸钾反应生成沉淀C为碳酸钡、碳酸银沉淀,溶液3中含硝酸钾、碳酸钾,应加硝酸再蒸发结晶、过滤得到硝酸钾,配制一定物质的量浓度的溶液时,要用到玻璃棒、烧杯、容量瓶,在转移溶液时,要用玻璃棒引流,以此来解答.
解答 解:利用含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,得到纯净的KNO3固体,由流程可知,①中加过量的硝酸钡,与K2SO4、K2CO3反应生成沉淀A为BaSO4、BaCO3,滤液中含KCl、硝酸钡、KNO3,②中与过量硝酸银反应生成沉淀B为AgCl沉淀,溶液2中含硝酸钡、硝酸银、硝酸钾,③中与过量碳酸钾反应生成沉淀C为碳酸钡、碳酸银沉淀,溶液3中含硝酸钾、碳酸钾,应加硝酸再蒸发结晶、过滤得到硝酸钾,
(1)由上述分析可知,沉淀A中含BaSO4、BaCO3,
故答案为:BaSO4;BaCO3;
(2)②中反应的离子方程式为Ag++Cl-═AgCl↓,
故答案为:Ag++Cl-═AgCl↓;
(3)③加入过量的K2CO3溶液的目的是除去Ba2+、Ag+,
故答案为:Ba2+、Ag+;
(4)实验室用上述实验获得的KNO3固体配制500mL0.40mol/LKNO3溶液.
①配制500mL0.40mol/LKNO3溶液,需要KNO3固体的质量为0.5L×0.40mol/L×101g/mol=20.2g,
故答案为:20.2;
②某同学转移溶液的操作如图所示,该同学操作中的错误是在转移溶液时,没有用玻璃棒引流,
故答案为:没有用玻璃棒引流;
③取100mL 0.40mol/L KNO3溶液加水稀释到400mL,稀释后溶液中NO3-的物质的量浓度为原来的$\frac{1}{4}$,即为 0.10mol/L,
故答案为:0.10.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法、及溶液的配制为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |

| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 1 mol NaOH | |
| B. | 该有机物水解所得产物能发生酯化反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物属于混合物 |
| A. | 200mL 2mol/L蔗糖溶液中所含分子数为0.4NA | |
| B. | 标准状况下,2.24L HF的氢原子数目为0.1 NA | |
| C. | 黑火药爆炸的方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑,当生成1molK2S时转移电子数为2NA | |
| D. | 标准状况下,1.12L 1H2和0.2g2H2均含有0.1 NA质子 |
| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
| A. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| B. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| C. | 只含有离子键的化合物才是离子化合物 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |