题目内容
5.完成下列各题.(1)中国的瓷器驰名世界,制备陶瓷是以粘土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成.若以氧化物形式表示粘土的组成,应写为:Al2O3•2SiO2•2H2O.
(2)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为:SiO2+4HF=SiF4↑+2H2O.
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气.写出该反应的化学方程式:2NaClO3+4HCl(浓)=Cl2↑+2ClO2+2NaCl+2H2O.
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅;
(3)氯酸钠和浓盐酸反应能生成二氧化氯、氯气、水和氯化钠.
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,[Al2Si2O5(OH)4]可改成Al2O3•2SiO2•2H2O,
故答案为:Al2O3•2SiO2•2H2O;
(2)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,氯酸钠和浓盐酸反应的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,故答案为:2NaClO3+4HCl(浓)=Cl2↑+2ClO2+2NaCl+2H2O.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写,明确物质的性质是解本题关键,根据反应物、生成物及反应条件书写方程式,题目难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
15.下列说法正确的是( )
| A. | 一个反应能否自发进行,由焓变、熵变、反应温度共同决定 | |
| B. | 在同一条件下,不同物质有不同的熵变,其体系混乱度越大,熵值越小 | |
| C. | 自发进行的反应一定能迅速发生 | |
| D. | 低温时,吸热且熵减的反应可能会自发发生 |
13. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
表中①、②处的数据分别是25、7.0.
III.讨论与交流
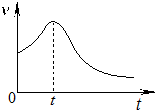
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
III.讨论与交流
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
20.室温下,下列各组离子能大量共存的是( )
| A. | 通入大量CO2的溶液中:K+、ClO-、SO32-、HCO3- | |
| B. | 能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- | |
| C. | 含有较多Al3+的溶液:Na+、SO42-、I-、ClO- | |
| D. | c(H+):c(OH-)=1:1012的水溶液中:CO32-、Na+、NO3-、AlO2- |
17.下列关于物质的分离表述不正确的是( )
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |
15.对于反应2NO2(g)?N2O4(g)△H<0,达到平衡后缩小容器体积,下列说法正确的是( )
| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |

 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.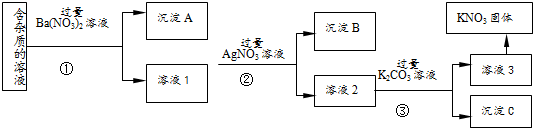
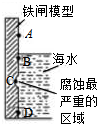 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,