题目内容
2.下列关于“焰色反应”的相关叙述不正确的是( )| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
分析 A.K元素的紫光能被黄光掩盖;
B.洁净无色的铁丝在火焰上灼烧时也无特殊颜色;
C.焰色反应是一种元素的性质;
D.盐酸易挥发,硫酸不挥发.
解答 解:A.物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,由于K元素的紫光能被黄光掩盖,可能含有钾元素,故A正确;
B.铁丝灼烧时无焰色,故可用洁净无锈的铁丝代替铂丝进行焰色反应实验,故B正确;
C.焰色反应是元素的性质,金属单质或其化合物等在灼烧时都可以产生相同的焰色,故C错误;
D.硫酸难挥发,清洗做焰色反应的铂丝后有残留,应该用盐酸洗涤铂丝,故D正确;
故选C.
点评 本题主要考查了焰色反应,难度不大,需要注意的是焰色反应是物理变化,表现的是某一种金属元素的性质.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
12.下列关于钠与水反应的说法不正确的是( )
①将一小块钠投入滴有石蕊试液的水中,反应后溶液变蓝
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会燃烧
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等.
①将一小块钠投入滴有石蕊试液的水中,反应后溶液变蓝
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会燃烧
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
13. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
表中①、②处的数据分别是25、7.0.
III.讨论与交流
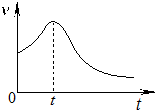
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
III.讨论与交流
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
17.下列关于物质的分离表述不正确的是( )
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |
7.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.指明使用镁条和氯酸钾的目的是引发铝热反应.(不超过8个字)
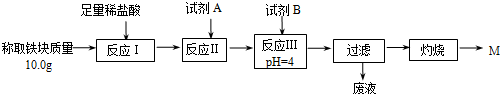
(2)某同学用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色.为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
②写出反应Ⅱ的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O
③设计简单实验证明M的成分是Fe2O3而非Fe3O4.
【限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水】
④上述实验应灼烧至M质量不变,则能证明M质量不变的标志是连续两次灼烧质量相差不大于0.1g.
⑤若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.指明使用镁条和氯酸钾的目的是引发铝热反应.(不超过8个字)
(2)某同学用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色.为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
②写出反应Ⅱ的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O
③设计简单实验证明M的成分是Fe2O3而非Fe3O4.
【限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水】
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入足量稀硫酸;观察. | 固体完全溶解,溶液呈黄色. |
继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察 | 溶液紫红色未褪去 |
⑤若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.
 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.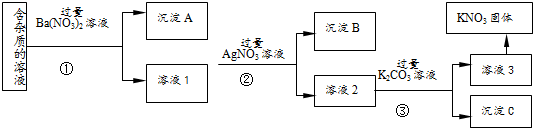
 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,