题目内容
19.下列有关叙述正确的是( )| A. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| B. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| C. | 只含有离子键的化合物才是离子化合物 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
分析 A.N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
B.电子能量与能层、能级有关;
C.离子化合物一定含有离子键,可能含有共价键;
D.含有离子键的化合物为离子化合物,分子晶体一定不含离子键,离子晶体中可能存在共价键.
解答 解:A.N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的,故A错误;
B.在基态多电子原子中,p轨道电子能量可能高于s轨道电子能量,若3p电子能量高于1s电子能量,也可能低于s轨道电子能量,如2p电子能量低于4s电子能量,故B错误;
C.离子化合物一定含有离子键,可能含有共价键,如NaOH、NH4Cl等,故C错误;
D.含有离子键的化合物为离子化合物,分子晶体一定不含离子键,离子晶体中可能存在共价键,故D正确,
故选:D.
点评 本题考查电离能、核外电子排布、晶体类型与构成等,比较基础,注意同周期元素第一电离能异常情况.

练习册系列答案
相关题目
9.下列离子方程式中,正确的是( )
| A. | 氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与盐酸反应:CO32-+2H+=CO2↑+H2O |
7.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.指明使用镁条和氯酸钾的目的是引发铝热反应.(不超过8个字)
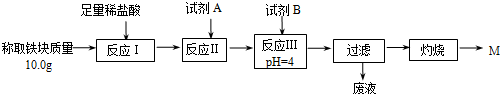
(2)某同学用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色.为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
②写出反应Ⅱ的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O
③设计简单实验证明M的成分是Fe2O3而非Fe3O4.
【限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水】
④上述实验应灼烧至M质量不变,则能证明M质量不变的标志是连续两次灼烧质量相差不大于0.1g.
⑤若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.指明使用镁条和氯酸钾的目的是引发铝热反应.(不超过8个字)
(2)某同学用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色.为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
②写出反应Ⅱ的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O
③设计简单实验证明M的成分是Fe2O3而非Fe3O4.
【限选试剂:稀盐酸、稀硫酸、氯水、高锰酸钾溶液、KSCN溶液、双氧水】
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入足量稀硫酸;观察. | 固体完全溶解,溶液呈黄色. |
继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察 | 溶液紫红色未褪去 |
⑤若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.
4.将氯气分别通入含有下列离子的溶液中,其中的离子不发生变化的是( )
| A. | SO42- | B. | Fe2+ | C. | S2- | D. | OH- |
11.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
| A. | ②③④⑤⑥⑦ | B. | ①③④⑤ | C. | ①②③④⑤⑦ | D. | ①③⑤ |
8.下列实验操作或处理正确的是( )
| A. | 将NaOH溶液逐滴加入饱和的FeCl3溶液中制取Fe(OH)3胶体 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | 金属钠着火立刻用湿布盖灭 | |
| D. | 做完焰色反应实验的铂丝用稀盐酸清洗 |
9.下列各物质中,不能由化合反应得到的是( )
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
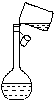 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.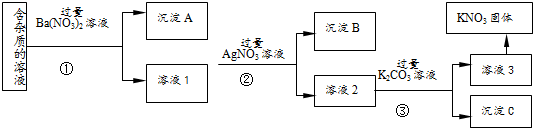
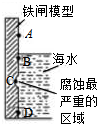 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,