题目内容
向含有7.4g Ca(OH)2的澄清石灰水中通入CO2气体后,得到8g白色沉淀,则通入的CO2气体的物质的量为( )
| A、0.08mol |
| B、0.10mol |
| C、0.12mol |
| D、0.18mol |
考点:化学方程式的有关计算
专题:计算题
分析:氢氧化钙和二氧化碳反应生成碳酸钙沉淀,碳酸钙沉淀会继续和二氧化碳反应生成碳酸氢钙,生成8g沉淀,有两种情况,一是生成沉淀8g,二是沉淀部分溶解剩余8g.
解答:
解:第一种情况
生成了8g的CaCO3,没有溶解沉淀
Ca(OH)2+CO2=CaCO3↓+H2O
1mol 100g
n1 8g
n1=
=0.08 mol;
第二种情况
先全部生成沉淀后,继续通入的CO2把沉淀溶解一部分,剩下了 8gCaCO3,
Ca(OH)2+CO2=CaCO3↓+H2O
74g 1mol 100g
7.4g n2 m
n2=
=0.1mol,m=
=10g,
即消耗了0.1 mol的CO2同时生成了10g沉淀,
则溶解的为 10g-8g=2 g
CaCO3+CO2+H2O=Ca(HCO3)2
100g 1mol
2g n3
n3=
=0.02mol
所以总共消耗的CO2为 0.1mol+0.02mol=0.12 mol
故选AC.
生成了8g的CaCO3,没有溶解沉淀
Ca(OH)2+CO2=CaCO3↓+H2O
1mol 100g
n1 8g
n1=
| 1mol×8g |
| 100g |
第二种情况
先全部生成沉淀后,继续通入的CO2把沉淀溶解一部分,剩下了 8gCaCO3,
Ca(OH)2+CO2=CaCO3↓+H2O
74g 1mol 100g
7.4g n2 m
n2=
| 7.4g×1mol |
| 74g |
| 7.4g×100g |
| 74g |
即消耗了0.1 mol的CO2同时生成了10g沉淀,
则溶解的为 10g-8g=2 g
CaCO3+CO2+H2O=Ca(HCO3)2
100g 1mol
2g n3
n3=
| 2g×1mol |
| 100g |
所以总共消耗的CO2为 0.1mol+0.02mol=0.12 mol
故选AC.
点评:本题考查了氢氧化钙和二氧化碳反应的计算,中等难度,明确反应原理是解题关键,易漏选C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA是阿伏加德罗常数,据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
| A、N4和N2是互为同位素 |
| B、1mol N4分子含有28NA个电子 |
| C、相同质量的N4和N2所含原子个数比为2:1 |
| D、N4的摩尔质量是56g |
已知2A(g)+B(g)?2C(g)+D(s),△H=-QkJ?mol-1,一定条件下,将2mol A和1mol B放入一体积可变的密闭容器中,测得容器体积为200L,一段时间达平衡后,测得体积变为140L,下列说法不正确的是( )
| A、平衡时A的转化率为90% |
| B、若要使达到平衡时的各气体的物质的量与题目的平衡相同,可充入2mol C和2mol D |
| C、在相同条件下,按2:1充入A和B,平衡时容器体积为210L,则充入A的物质的量为3mol |
| D、相同条件下,若充入4mol C和2mol D,达平衡时放出能量1.8QkJ |
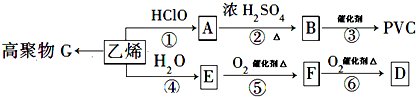
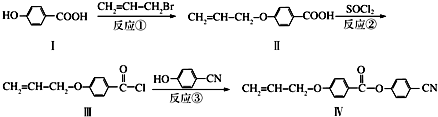
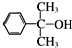 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是