题目内容
用8.7克MnO2与10mol/L的盐酸120ml反应制取Cl2
(1)在标况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1L后取出20ml(不考虑HCl损失),在这20ml溶液中加入足量的AgNO3溶液,可得AgCl多少克.
(1)在标况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1L后取出20ml(不考虑HCl损失),在这20ml溶液中加入足量的AgNO3溶液,可得AgCl多少克.
考点:化学方程式的有关计算
专题:
分析:(1)二者发生反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,n(MnO2)=
=0.1mol,n(HCl)=10mol/L×0.12L=1.2mol>0.4mol,所以二氧化锰的量不足,根据二氧化锰和氯气之间的关系式计算;
(2)氯离子和银离子发生反应Ag++Cl-=AgCl↓,根据氯原子守恒计算m(AgCl).
| ||
| 8.7g |
| 87g/mol |
(2)氯离子和银离子发生反应Ag++Cl-=AgCl↓,根据氯原子守恒计算m(AgCl).
解答:
解:(1)二者发生反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,n(MnO2)=
=0.1mol,n(HCl)=10mol/L×0.12L=1.2mol>0.4mol,所以二氧化锰的量不足,设生成氯气的物质的量为x,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1mol 1mol
0.1mol x
1mol:1mol=0.1mol:x
x=
=0.1mol,
V(Cl2)=0.1mol×22.4L/mol=2.24L,
答:在标况下可生成2.24升氯气;
(2)反应后溶液中n(Cl-)=n(HCl)-2n(Cl2)=1.2mol-2×0.1mol=1mol,稀释后20ml溶液占总体积的
,则溶液中氯离子的物质的量应该是总溶液中的
,为0.01mol,
氯离子和银离子发生反应Ag++Cl-=AgCl↓,
根据氯原子守恒得n(AgCl)=n(Cl-)=0.02mol,则m(AgCl)=0.02mol×143.5g/mol=2.87g,
答:可得AgCl2.87g.
| ||
| 8.7g |
| 87g/mol |
MnO2+4HCl(浓)
| ||
1mol 1mol
0.1mol x
1mol:1mol=0.1mol:x
x=
| 1mol×0.1mol |
| 1mol |
V(Cl2)=0.1mol×22.4L/mol=2.24L,
答:在标况下可生成2.24升氯气;
(2)反应后溶液中n(Cl-)=n(HCl)-2n(Cl2)=1.2mol-2×0.1mol=1mol,稀释后20ml溶液占总体积的
| 1 |
| 50 |
| 1 |
| 50 |
氯离子和银离子发生反应Ag++Cl-=AgCl↓,
根据氯原子守恒得n(AgCl)=n(Cl-)=0.02mol,则m(AgCl)=0.02mol×143.5g/mol=2.87g,
答:可得AgCl2.87g.
点评:本题考查方程式的有关计算,明确方程式中各个物理量的关系是解本题关键,注意稀盐酸和二氧化锰不反应,注意原子守恒的利用,题目难度不大.

练习册系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的原子半径最小,Z元素和X元素在一定条件下能形成XZ,Y和W的原子序数相差8,W和Y可形成两种常见的气态化合物.下列叙述正确的是( )
| A、X与Y可形成原子个数比1:1的化合物 |
| B、化合物XZ的沸点高于X与Y形成化合物的沸点 |
| C、W的含氧酸是一种强酸 |
| D、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
向含有7.4g Ca(OH)2的澄清石灰水中通入CO2气体后,得到8g白色沉淀,则通入的CO2气体的物质的量为( )
| A、0.08mol |
| B、0.10mol |
| C、0.12mol |
| D、0.18mol |
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量一定不可能是( )
| A、5g | B、4g | C、8g | D、10g |
将铁铝矾[Al2Fe(SO4)4?xH2O]溶于水中,得到浅绿色溶液,下列有关该溶液的叙述正确的是( )
| A、铁铝矾有净水作用,其水溶液显中性 |
| B、向该溶液中加入Na2S溶液,有淡黄色沉淀 |
| C、在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 |
| D、用惰性电极电解该溶液时,阴极区有沉淀 |
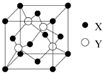 元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍.