题目内容
8.写出下列反应的现象及离子反应方程式(1)Ba(OH)2溶液中慢慢通入SO2至过量,现象:开始生成白色沉淀,随后白色沉淀溶解;离子反应方程式:Ba2++2OH-+SO2=BaSO3↓+H2O,.
(2)AlCl3、MgSO4的混合溶液中加入过量NaOH溶液,现象:生成白色沉淀,继续加入氢氧化钠溶液不是沉淀部分溶解;离子反应方程式;Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)二氧化硫是酸性氧化物和氢氧化钡溶液反应生成亚硫酸钡白色沉淀,继续通入二氧化硫,不是沉淀溶解为无色溶液;
(2)AlCl3、MgSO4的混合溶液中加入过量NaOH溶液,随氢氧化钠溶液加入生成白色沉淀,继续加入氢氧化钠溶液,生成的氢氧化铝溶解生成偏铝酸钠;
解答 解;(1)二氧化硫是酸性氧化物和氢氧化钡溶液反应生成亚硫酸钡白色沉淀,反应的离子方程式:Ba2++2OH-+SO2=BaSO3↓+H2O,继续通入二氧化硫,不是沉淀溶解为无色溶液,反应的离子方程式为:BaSO3↓+H2O+SO2=Ba2++2HSO3-,
故答案为:开始生成白色沉淀,随后白色沉淀溶解,Ba2++2OH-+SO2=BaSO3↓+H2O,BaSO3↓+H2O+SO2=Ba2++2HSO3-;
(2)AlCl3、MgSO4的混合溶液中加入过量NaOH溶液,随氢氧化钠溶液加入生成白色沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,继续加入氢氧化钠溶液,生成的氢氧化铝溶解生成偏铝酸钠,白色沉淀部分溶解,Al(OH)3+OH-=AlO2-+2H2O,
故答案为:生成白色沉淀,继续加入氢氧化钠溶液不是沉淀部分溶解,Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Al(OH)3+OH-=AlO2-+2H2O;
点评 本题考查了二氧化硫、镁离子、铝离子性质分析,主要是量不同产物不同的判断和离子方程式书写,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列关于庚烷的同分异构体说法正确的是( )
| A. | 主链上有6个碳的庚烷有3种 | |
| B. | 主链4个碳,可能只含一个支链 | |
| C. | 主链5个碳,支链可以只含乙基,也可以只含甲基 | |
| D. | 主链为3个碳时,支链形成的同分异构体含两个乙基支链,碳架结构为: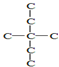 |
19. 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 正极反应为:O2+4e-+2H2O=4OH- |
16.若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是( )
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- K+[Al(OH)4]- OH- | D. | NO3- Ba2+ K+ Cl- |
3.下列化学变化需加入氧化剂才能发生的是( )
| A. | NO3-→NO2 | B. | Al(OH)3→AlO2- | C. | SO32-→SO2 | D. | Br-→Br2 |
13.有机物种类繁多的原因的主要原因( )
| A. | 有机物分子结构十分复杂 | |
| B. | 自然界中存在着多种形式的大量的有机物 | |
| C. | 碳原子能与其他原子形成四个共价键,且碳原子间也可以成键,而且有同分异构现象 | |
| D. | 有机物除含碳元素之外,还含有其他多种元素 |
20.下列有机物互为同分异构体的一组是( )
| A. | 纤维素和淀粉 | B. | 乙醇和乙酸 | C. | 甲烷与丁烷 | D. | 乙醇与二甲醚 |
17.反应C2H4(g)+3O2(g)═2CO2(g)+2H2O(g) 在四种不同情况下的反应速率分别为:
①v(C2H4)=0.45mol/(L•s)
②v(O2)=0.6mol/(L•s)
③v(CO2)=0.4mol/(L•s)
④v(H2O)=0.45mol/(L•s)
下列有关反应速率的比较中正确的是( )
①v(C2H4)=0.45mol/(L•s)
②v(O2)=0.6mol/(L•s)
③v(CO2)=0.4mol/(L•s)
④v(H2O)=0.45mol/(L•s)
下列有关反应速率的比较中正确的是( )
| A. | ①>②>③>④ | B. | ④>③>②>① | C. | ④>③=②>① | D. | ①>④>②=③ |
18.25℃时,某溶液中含有HCO${\;}_{3}^{-}$、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$、CH3COO-四种阴离子,当向其中加入足量的Na2O2固体并降温至25℃后,下列有关溶液中离子浓度变化的说法错误的是(假设溶液的体积无变化)( )
| A. | CH3COO-的浓度基本不变 | |
| B. | SO${\;}_{3}^{2-}$的浓度减小,而SO${\;}_{4}^{2-}$的浓度增大 | |
| C. | CO${\;}_{3}^{2-}$的浓度减小,溶液碱性增强 | |
| D. | HCO${\;}_{3}^{-}$的浓度减,OH-的浓度增大 |