题目内容
18.25℃时,某溶液中含有HCO${\;}_{3}^{-}$、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$、CH3COO-四种阴离子,当向其中加入足量的Na2O2固体并降温至25℃后,下列有关溶液中离子浓度变化的说法错误的是(假设溶液的体积无变化)( )| A. | CH3COO-的浓度基本不变 | |
| B. | SO${\;}_{3}^{2-}$的浓度减小,而SO${\;}_{4}^{2-}$的浓度增大 | |
| C. | CO${\;}_{3}^{2-}$的浓度减小,溶液碱性增强 | |
| D. | HCO${\;}_{3}^{-}$的浓度减,OH-的浓度增大 |
分析 Na2O2具有强氧化性,可与SO32-发生氧化还原反应生成硫酸根离子;Na2O2与水反应生成NaOH,可与HCO3-反应生成CO32-,导致碳酸根离子浓度增大,溶液碱性增强,以此解答该题.
解答 解:A.CH3COO-与过氧化钠、氢氧化钠都不反应,离子浓度不变,故A正确;
B.SO32-具有还原性,能够被过氧化钠氧化,亚硫酸根离子浓度减小,SO42-的浓度增大,故B正确;
C.CO32-与过氧化钠、氢氧化钠都不反应,而HCO3-能够与氢氧化钠反应生成碳酸钠,所以碳酸氢根离子浓度减小,CO32-的浓度增大,故C错误;
D.HCO3-能够与氢氧化钠反应生成碳酸钠,所以HCO3-浓度减小,过氧化钠与水反应生成氢氧化钠,导致溶液碱性增强,故D正确;
故选C.
点评 本题考查了钠的化合物性质,题目难度不大,明确发生的反应原理为解答关键,注意掌握过氧化钠的化学性质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.设NA为阿伏加德罗常数值.下列有关叙述不正确的是( )
| A. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA | |
| B. | 0.2 mol C2H6分子中一定存在0.2NA个碳碳单键 | |
| C. | 1 mol Fe溶于过量硝酸,电子转移数为3NA | |
| D. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA |
13.下列说法正确的是( )
| A. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| B. | Na3N是离子化合物,溶于水后得到的溶液能使无色酚酞试液变红 | |
| C. | 2Na2O2+2H2O═4NaOH+O2↑,是水作还原剂的氧化还原反应 | |
| D. | 过氧化钠会因为与空气中的氧气反应而易变质 |
3.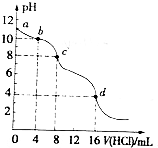 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
10.下列金属腐蚀不属于电化学腐蚀的是( )
| A. | 硫酸厂里钢铁设备表面锈迹斑斑 | |
| B. | 夏天,家用铁锅易出现锈斑 | |
| C. | 铝壶里盛装醋酸除水垢,发现漏水 | |
| D. | 自来水铜质龙头与铁管接口处出现红褐色锈斑 |
17.已知 X 元素的某种同位素的氯化物 XCln为离子化合物,在该化合物中 X 元素的粒子的核内中子数为 m,核外电子数为 y,则该同位素的符号是( )
| A. | myX | B. | y+myX | C. | y+nm+y+nX | D. | y+ny+m-n× |
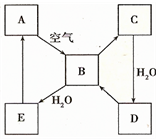 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.