题目内容
下列反应中硫酸既表现氧化性,又表现酸性的有( )
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
考点:氧化还原反应
专题:
分析:硫酸在反应中表现为氧化性,应存在化合价的变化,S元素的化合价降低,又表现出酸性,应生成硫酸盐.
解答:
解:A.2H2SO4(浓)+Cu
CuSO4+2H2O+SO2↑,S元素的化合价降低,浓硫酸表现为氧化性,生成CuSO4,又表现为酸性,故A正确;
B.2H2SO4 (浓)+C
2SO2↑+CO2↑+2H2O,S元素的化合价降低,浓硫酸只表现为氧化性,故B错误;
C.H2SO4 (浓)+NaCl
NaHSO4+HCl↑,没有元素化合价的变化,浓硫酸没表现出氧化性,故C错误;
D.Na2SO3和浓硫酸发生反应,没有元素化合价变化,硫酸不表现氧化性,只表现酸性,故D错误.
故选A.
| ||
B.2H2SO4 (浓)+C
| ||
C.H2SO4 (浓)+NaCl
| ||
D.Na2SO3和浓硫酸发生反应,没有元素化合价变化,硫酸不表现氧化性,只表现酸性,故D错误.
故选A.
点评:本题考查浓硫酸的性质,题目难度不大,本题注意氧化性和酸性的判断角度,为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、硝酸银与盐酸反应:AgNO3+Cl-═AgCl↓+NO3- |
| B、铜片插入硝酸银溶液中:Cu+Ag+═Ag+Cu2+ |
| C、硫酸和氯化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| D、铁钉放入硫酸铜溶液中:2Fe+3Cu2+═2Fe3++3Cu |
关于CaCO3沉淀的溶解平衡说法正确的是( )
| A、CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C、升高温度,CaCO3沉淀的溶解度无影响 |
| D、向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |
下列叙述正确的是( )
| A、25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,向浓度均为0.1 mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1 mol?L-1的Na2CO3溶液,首先生成 CaCO3沉淀 |
| B、0.1 mol/LNa2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
| C、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| D、已知Fe3++2 I-=Fe2++I2,则浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应 |
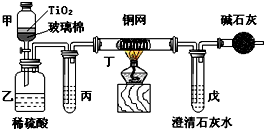 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.