题目内容
 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.(1)O3将I-氧化成I2的过程可发生如下反应:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
④O3(g)+2I-(aq)+2H+(aq)═I2(aq)+O2(g)+H2O(l)△H4
则△H3与△H1、△H2、△H4之间的关系是:△H3=
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq)其平衡常数表达式为
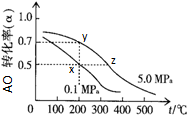
(3)为探究温度对I2(aq)+I-(aq)?I3-(aq)△H5反应的影响.在某温度T1下,将一定量的0.2mol?L-1 NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应),在t时刻,测得容器中I2(g)的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一).则:

①若在T3时,容器中无O3,T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,则△H5
②若在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,其可能的原因是
(4)利用反应④和图2的信息,计算0-t1时间段内用I2(aq)表示的化学反应速率
考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:(1)利用盖斯定律进行计算;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来分析;
(3)①在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+Iˉ(aq)?I3ˉ(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),由于该反应是吸热反应,升高温度能使平衡I2(aq)+Iˉ(aq) I3ˉ(aq)正向移动,从而使Iˉ浓度减小;
T5温度下Iˉ的转化率为一定大于55%,Iˉ的平衡浓度要小于0.04mol/L,所以拐点(平衡点)的位置坐标应在Iˉ浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上.由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线;
②O3继续氧化I-使溶液中I2浓度增加,使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加或者溶液温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,气体I2浓度增加;
(4)根据图二所示Iˉ浓度的数据可计算出用Iˉ(aq)表示的化学反应速率,再根据(1)中反应④的化学方程式中Iˉ(aq)与I2(aq)的化学计量数之比2:1,得出用I2(aq)表示的化学反应速率.
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来分析;
(3)①在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+Iˉ(aq)?I3ˉ(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),由于该反应是吸热反应,升高温度能使平衡I2(aq)+Iˉ(aq) I3ˉ(aq)正向移动,从而使Iˉ浓度减小;
T5温度下Iˉ的转化率为一定大于55%,Iˉ的平衡浓度要小于0.04mol/L,所以拐点(平衡点)的位置坐标应在Iˉ浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上.由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线;
②O3继续氧化I-使溶液中I2浓度增加,使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加或者溶液温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,气体I2浓度增加;
(4)根据图二所示Iˉ浓度的数据可计算出用Iˉ(aq)表示的化学反应速率,再根据(1)中反应④的化学方程式中Iˉ(aq)与I2(aq)的化学计量数之比2:1,得出用I2(aq)表示的化学反应速率.
解答:
解:(1)①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
④O3(g)+2I-(aq)+2H+(aq)═I2(aq)+O2(g)+H2O(l)△H4
观察已知的4个热化学方程式中的反应物和生成物,可以知道,由④-②-①,即可得到③式,所以,△H4-△H2-△H1;
故答案为:△H4-△H2-△H1;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,可得反应I2(aq)+Iˉ(aq) I3ˉ(aq)的平衡常数表达式K=
;
已知O3将Iˉ氧化成I2的过程中可发生4个反应,所以在反应的整个过程中I3ˉ物质的量浓度变化情况是:开始时随着O3的通入,O3可以将I-氧化成I2,I2与I-结合形成I3-,从而使I3ˉ物质的量浓度增大;由于O3具有极强氧化性,通入的O3还可以将I-氧化为IO-和氧气,随着O3的持续通入,O3将一部分I-氧化为IO-和氧气,使I-消耗量增大,同时I2 生成量减少,从而使I3-的浓度变小,
故答案为:
;先增加后减小;
(3)①在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+Iˉ(aq)?I3ˉ(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),所以在不考虑其它因素时,I2(g)浓度会增加,但是从图一T4→T5 所示的I2(g)浓度变化曲线看,实际上升高温度I2(g)浓度减少,那么只能判断是温度升高致使平衡I2(aq)+Iˉ(aq)?I3ˉ(aq) 正向移动,移动结果使I2(aq)浓度减小,从而导致I2(ag)?I2(g)平衡逆向移动,使I2(g)浓度减小,由此可以判断△H5>0,I2(aq)+Iˉ(aq)?I3ˉ(aq)是吸热反应.要画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线,必须首先确定曲线的起点、拐点和终点,已知图二所示的曲线是温度在T4时,溶液中Iˉ浓度随时间变化的趋势曲线,根由曲线分析可知反应己达到平衡,在t2时,反应体系温度上升到T5,并维持该温度,是改变的反应条件(升高温度),此时平衡必然会发生移动,所以T5温度下曲线的起点就是T4温度下曲线的终点,坐标位置应为(0.09,t2).由于升高温度加快反应速率,缩短达到平衡的时间,所以在T5温度下,达到平衡所用的时间要比T4温度下少,所以拐点出现所需时间比T4温度下少.由于该反应是吸热反应,升高温度能使平衡I2(aq)+Iˉ(aq)?I3ˉ(aq)正向移动,从而使Iˉ浓度减小.结合图二中的数据可知,T4温度下Iˉ转化浓度为0.11mol/L,转化率为
×100%-55%,所以T5温度下Iˉ的转化率为一定大于55%,Iˉ的平衡浓度要小于0.09mol/L-(0.09mol/L×55%)≈0.04mol/L.所以拐点(平衡点)的位置坐标应在Iˉ浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上.由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线为
 故答案为:>;
故答案为:>; ;
;
②在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,可能是:a.由于容器中还有O3,O3继续氧化I-使溶液中I2浓度增加,从而使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加;b.体系的温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,从而气体I2浓度增加.
故答案为:O3继续氧化I-使溶液中I2浓度增加,使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加或者溶液温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,气体I2浓度增加;
(4)根据图二所示Iˉ浓度的数据可计算出用Iˉ(aq)表示的化学反应速率:V(I-)=
mol?L-1?min-1,再根据(1)中反应④的化学方程式中Iˉ(aq)与I2(aq)的化学计量数之比2:1,得出用I2(aq)表示的化学反应速率:V (I2)=
mol?L-1?min-1.
故答案为:
mol?L-1?min-1.
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
④O3(g)+2I-(aq)+2H+(aq)═I2(aq)+O2(g)+H2O(l)△H4
观察已知的4个热化学方程式中的反应物和生成物,可以知道,由④-②-①,即可得到③式,所以,△H4-△H2-△H1;
故答案为:△H4-△H2-△H1;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,可得反应I2(aq)+Iˉ(aq) I3ˉ(aq)的平衡常数表达式K=
c(
| ||
| c(I2)?c(I-) |
已知O3将Iˉ氧化成I2的过程中可发生4个反应,所以在反应的整个过程中I3ˉ物质的量浓度变化情况是:开始时随着O3的通入,O3可以将I-氧化成I2,I2与I-结合形成I3-,从而使I3ˉ物质的量浓度增大;由于O3具有极强氧化性,通入的O3还可以将I-氧化为IO-和氧气,随着O3的持续通入,O3将一部分I-氧化为IO-和氧气,使I-消耗量增大,同时I2 生成量减少,从而使I3-的浓度变小,
故答案为:
c(
| ||
| c(I2)?c(I-) |
(3)①在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+Iˉ(aq)?I3ˉ(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),所以在不考虑其它因素时,I2(g)浓度会增加,但是从图一T4→T5 所示的I2(g)浓度变化曲线看,实际上升高温度I2(g)浓度减少,那么只能判断是温度升高致使平衡I2(aq)+Iˉ(aq)?I3ˉ(aq) 正向移动,移动结果使I2(aq)浓度减小,从而导致I2(ag)?I2(g)平衡逆向移动,使I2(g)浓度减小,由此可以判断△H5>0,I2(aq)+Iˉ(aq)?I3ˉ(aq)是吸热反应.要画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线,必须首先确定曲线的起点、拐点和终点,已知图二所示的曲线是温度在T4时,溶液中Iˉ浓度随时间变化的趋势曲线,根由曲线分析可知反应己达到平衡,在t2时,反应体系温度上升到T5,并维持该温度,是改变的反应条件(升高温度),此时平衡必然会发生移动,所以T5温度下曲线的起点就是T4温度下曲线的终点,坐标位置应为(0.09,t2).由于升高温度加快反应速率,缩短达到平衡的时间,所以在T5温度下,达到平衡所用的时间要比T4温度下少,所以拐点出现所需时间比T4温度下少.由于该反应是吸热反应,升高温度能使平衡I2(aq)+Iˉ(aq)?I3ˉ(aq)正向移动,从而使Iˉ浓度减小.结合图二中的数据可知,T4温度下Iˉ转化浓度为0.11mol/L,转化率为
| (0.2-0.09)mol/L |
| 0.2mol/L |
 故答案为:>;
故答案为:>; ;
;②在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,可能是:a.由于容器中还有O3,O3继续氧化I-使溶液中I2浓度增加,从而使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加;b.体系的温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,从而气体I2浓度增加.
故答案为:O3继续氧化I-使溶液中I2浓度增加,使I2(aq) I2(g)平衡向正方向移动,气体I2浓度增加或者溶液温度升高,使I2(aq) I2(g)△H>0,平衡向正方向移动,气体I2浓度增加;
(4)根据图二所示Iˉ浓度的数据可计算出用Iˉ(aq)表示的化学反应速率:V(I-)=
| 0.11 |
| t1 |
| 0.11 |
| 2t1 |
故答案为:
| 0.11 |
| 2t1 |
点评:本题考查了转化率为化学反应与能量、化学反应速率、化学平衡 等知识点,难度较大,注意对图象进行分析找出解题的关键点.

练习册系列答案
相关题目
下列离子方程式中正确的是( )
| A、将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B、Na2S水解:S2-+2H2O?H2S+2OH- |
| C、向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| D、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10-9mol2?L-2,Ksp(BaSO4)=1.1×10-10 mol2?L-2,则下列说法中正确的是( )
| A、BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3) |
| B、在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀 |
| C、在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理 |
| D、用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理 |
类比推断法是研究物质性质的常用方法之一,可预测许多物质的性质.但类比推断法是相对的,不能违背客观实际.下列说法正确的是( )
| A、由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B、向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C、由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D、有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |
下列反应中硫酸既表现氧化性,又表现酸性的有( )
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
 磷单质及其化合物在工业有广泛应用.
磷单质及其化合物在工业有广泛应用. 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( ) (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: