题目内容
2.肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂.(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
分析 (1)反应热=反应物总键能-生成物总键能;
(2)①升高温度,反应速率加快,到达平衡时间缩短,平衡向正反应方向移动,NO的产率增大;
②若开始向容器中加入1 mol/L的NO2,发生反应:2NO2(g)?2NO(g)+O2(g),二氧化氮与NO的物质的量之比为1:1,则反应过程中NO的产率与NO的浓度相等,故平衡时NO浓度为0.6mol/L,利用三段式计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$计算平衡常数,再计算此时的浓度商Qc,与平衡常数相比判断反应进行方向,进而确定v(正)、v(逆)相对大小;
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,前10min内,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;
平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,代入物质的浓度计算;
②根据v=$\frac{△c}{△t}$计算v(NO2);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小.
解答 解:(1)设1mol N2O4(1)完全分解成相应的原子时需要吸收的能量QKJ,则:
190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,
解得Q=1793,
故答案为:1793kJ;
(2)①升高温度,反应速率加快,到达平衡时间缩短,平衡向正反应方向移动,NO的产率增大,反应在820℃时进行,NO的产率随时间的变化曲线为: ,
,
故答案为: ;
;
②若开始向容器中加入1 mol/L的NO2,发生反应:2NO2(g)?2NO(g)+O2(g),二氧化氮与NO的物质的量之比为1:1,则反应过程中NO的产率与NO的浓度相等,故平衡时NO浓度为0.6mol/L,则:
2NO2(g)?2NO(g)+O2(g)
开始(mol/L):1 0 0
转化(mol/L):0.6 0.6 0.4
平衡(mol/L):0.4 0.6 0.4
则平衡常数K=$\frac{{c}^{2}(NO)×c({O}_{2})}{{c}^{2}(N{O}_{2})}$=$\frac{0.{6}^{2}×0.4}{0.{4}^{2}}$=0.9,此时的浓度商Qc=$\frac{{1}^{2}×0.2}{0.{5}^{2}}$=0.8<K=0.9,故反应向正反应进行,则v(正)>v(逆),
故答案为:>;
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,10min时到达平衡,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;
平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.{6}^{2}}{0.4}$=0.9,
故答案为:0.9;
②v(NO2)=$\frac{0.6mol/L-0.2mol/L}{10min}$=0.04mol/(L.min);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小,
故答案为:0.04mol/(L.min);增大NO2的浓度;b.
点评 本题考查化学平衡有关计算、化学平衡影响移动、反应热计算等,为高频考点和常见题型,是对学生综合能力的考查,难度中等.

(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx$\frac{\underline{\;催化剂\;}}{\;}$(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如图1
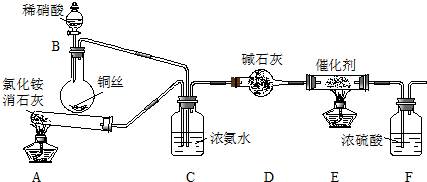
①装置A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②装置D中碱石灰的作用是除去气体中含有的水蒸气.
(2)用Na2CO3溶液吸收法处理NOx.
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3═2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3═NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是D(填字母).
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为1.875.
(3)用固体氧化物电解池通过电解方式分解NOx.当以Pt作电极时,固体氧化物电解池还原NO示意图如图2.
298K时,有关实验数据如下,(化学反应消耗的电能占总电能的80%)
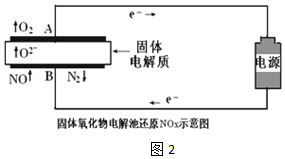
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
①根据实验组1数据,NO分解的热化学方程式2NO(g)=N2(g)+O2(g)△H=+3.2akJ•mol-1
②实验组2明显比实验组1生成的N2少,其原因用电极反应式表示为O2+4e-=2O2-或2NO2+8e-=4O2-+N2.
 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
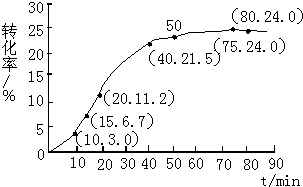
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$,则该反应在温度T1下的K值为$\frac{1}{7}$.
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
| A. | 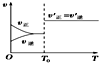 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 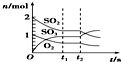 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
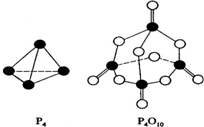
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.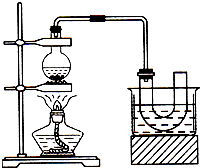 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃): 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: