题目内容
4.为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):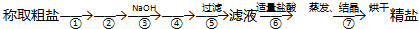
(1)第①步操作的名称是溶解,
第②步加入的试剂化学式为BaCl2,
(2)第④步加入试剂的化学式为Na2CO3,
此步相关的离子方程式是Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓.
(3)第⑤步操作所需玻璃仪器是:烧杯、玻璃棒和漏斗(填名称).
分析 称取粗盐后,应先将粗盐溶解,然后加入除杂试剂BaCl2、NaOH和Na2CO3,过滤,然后加盐酸,再蒸发结晶即可.由于Na2CO3不但要除去CaCl2,还要除去过量的BaCl2,故BaCl2的加入一定要在Na2CO3之前,而③加入的是NaOH,故②加入的是BaCl2,④加入的是Na2CO3.据此分析.
解答 解:(1)称取粗盐后,应先将粗盐溶解,然后加入除杂试剂BaCl2、NaOH和Na2CO3,过滤,然后加盐酸,再蒸发结晶即可.由于Na2CO3不但要除去CaCl2,还要除去过量的BaCl2,故BaCl2的加入一定要在Na2CO3之前,而③加入的是NaOH,故②加入的是BaCl2,④加入的是Na2CO3.故答案为:溶解;BaCl2;
(2)第④步加入的是Na2CO3,加入Na2CO3的目的是要除去CaCl2和过量的BaCl2,故离子方程式为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,
故答案为:Na2CO3;Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓;
(3)过滤操作用到的主要仪器有:铁架台、烧杯、漏斗和玻璃棒,其中玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:漏斗.
点评 本题考查了粗盐的除杂提纯,难度不大,应注意的是试剂加入顺序的分析,即BaCl2的加入一定要在Na2CO3之前.

练习册系列答案
相关题目
17.把1gNaOH溶于水配制成50mL溶液,所得溶液中NaOH的物质的量浓度为( )
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
18.X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )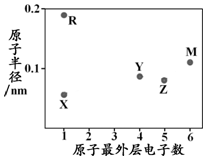

| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
16.为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
. 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.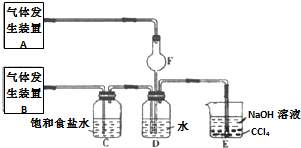
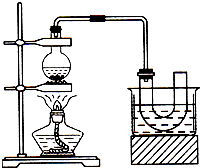 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):