题目内容
5.下列说法正确的是( )| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
分析 A.元素的种类由质子数决定;
B.化学键是存在于原子、离子间的作用力;
C.原子核内质子数与中子数不同,则为不同的原子;
D.化学限度与物质的性质以及外界条件有关.
解答 解:A.最外层电子数决定元素的化学性质,元素的种类由质子数决定,故A错误;
B.分子间的作用力较弱,不是化学键,化学键是存在于原子、离子间的作用力,作用力较强,故B错误;
C.原子含有一定的中子和质子,原子核内质子数与中子数不同,则为不同的原子,故C正确;
D.化学反应速率的大小与反应快慢有关,化学限度与物质的性质以及外界条件有关,故D错误.
故选C.
点评 本题考查较为综合,涉及原子的结构、化学键以及化学反应限度,为高频考点,侧重考查学生的分析能力,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法不正确的是( )
| A. | 有机物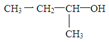 的名称为2-丁醇 的名称为2-丁醇 | |
| B. | 蛋白质、淀粉、纤维素都是高分子化合物 | |
| C. | 合成有机物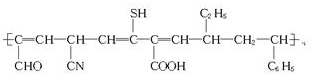 使用的单体有3种 使用的单体有3种 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |
16.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧聚乙炔.其中既能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
| A. | ②③⑤ | B. | ②③⑦ | C. | ②③⑧ | D. | ②③⑦⑧ |
13.下列实验现象与结论不一致的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体 | HA放出氢气的反应速率更快 | 酸性:HB<HA |
| B | 以铜、铁、浓硝酸构成原电池 | 铁表面有红棕色气泡产生 | 铜作原电池的负极 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCls饱和溶液 | 前者为黄色,后者为红褐色 | 升高温度,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中 | 一段时间后,检验固体主要成分为CaCO3 | Ksp ( CaSO4)<Ksp ( CaCO3 ) |
| A. | A | B. | B | C. | C | D. | D |
20.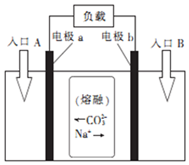 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )| A. | 该电池的总反应为C+O2═CO2 | |
| B. | 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高 | |
| C. | 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响 | |
| D. | 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉 |
17.根据原子结构及元索周期律的知识,下列叙述正确的是( )
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 由子F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
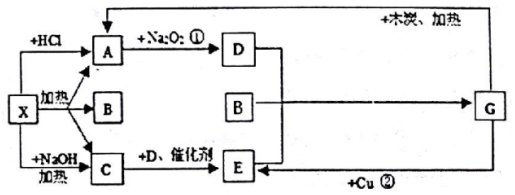
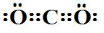 ;G的化学式为HNO3.
;G的化学式为HNO3.